
分析 (1)根据化学变化前后原子的种类、数目不变,由反应的化学方程式2CaCO3+O2+2SO2=2CaSO4+2X,推断反应中生成物X的分子构成,根据分子的构成确定X物质的化学式.
(2)根据化学方程式和题中所给的数据进行计算.
解答 解:(1)由反应的化学方程式2CaCO3+O2+2SO2=2CaSO4+2X,可知反应前后各原子的个数为
反应前 反应后
Ca原子 2 2
C原子 2 0
O原子 12 8
S原子 2 2
根据化学变化前后原子的种类、数目不变,可判断生成物X的2个分子中含有2个C原子和4个O原子,则每个X分子由1个C原子和2个O原子构成,物质X的化学式为CO2;
(2)设需要CaCO3的质量为x
2CaCO3+O2+2SO2═2CaSO4+2CO2,
200 128
x 3.2t
$\frac{200}{x}=\frac{128}{3.2t}$
x=5t
需含碳酸钙90%的石灰石质量为$\frac{5t}{90%}$≈5.6t
答:至少需要含90%碳酸钙的石灰石5.6t.
点评 本题主要考查了化学方程式的计算,难度不大,注意解题的规范性和准确性.


科目:初中化学 来源: 题型:计算题
| 酯的名称 | 甲酸甲酯 | 甲酸乙酯 | 乙酸甲酯 | 乙酸乙酯 |
| 化学式 | C2H4O2 | C3H6O2 | C3H6O2 | X |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
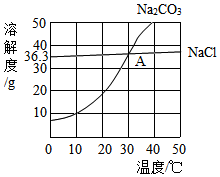 如图为氯化钠、碳酸钠在水中的溶解度曲线,其中氯化钠、碳酸钠两物质的溶解度曲线交点为A.下列说法正确的是( )
如图为氯化钠、碳酸钠在水中的溶解度曲线,其中氯化钠、碳酸钠两物质的溶解度曲线交点为A.下列说法正确的是( )| A. | 碳酸钠俗称小苏打 | |
| B. | 30℃时,氯化钠的溶解度为36.3g | |
| C. | 碳酸钠的溶解度大于氯化钠的溶解度 | |
| D. | 将Na2CO3和NaCl均达到饱和的混合溶液,从40℃降温到20℃时,析出的固体物质主要是NaCl |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
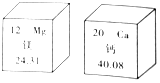 俗话说:“补钙不补镁,补了也后悔”,原来镁有协同钙的作用,会促进钙的吸收.如图是镁、钙在元素周期表中的部分信息,则下列说法不正确的是( )
俗话说:“补钙不补镁,补了也后悔”,原来镁有协同钙的作用,会促进钙的吸收.如图是镁、钙在元素周期表中的部分信息,则下列说法不正确的是( )| A. | 镁和钙都属于金属元素 | B. | 在金属活动性顺序中,镁比钙活泼 | ||
| C. | 镁原子的质子数为12 | D. | 钙的相对原子质量为40.08 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | C4H8FeN2O4的相对分子质量为204g | B. | 该物质改善缺铁性贫血 | ||
| C. | 该物质是有机高分子化合物 | D. | 钙、锌、硒都是人体必需的微量元素 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
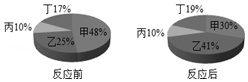 在密闭容器中有甲、乙、丙、丁四种物质,在一定的条件下充分反应,测得反应前后各物质的质量分数如图所示,下列说法正确的是( )
在密闭容器中有甲、乙、丙、丁四种物质,在一定的条件下充分反应,测得反应前后各物质的质量分数如图所示,下列说法正确的是( )| A. | 丁一定是化合物 | B. | 丙一定是这个反应的催化剂 | ||
| C. | 该反应一定是分解反应 | D. | 该反应可能是碳酸钙的分解 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com