


科目:初中化学 来源: 题型:
| OH- | N
|
Cl- | C
|
S
| |||||||
| H+ | 溶、挥 | 溶、挥 | 溶、挥 | 溶 | |||||||
| Ca2+ | 微 | 溶 | 溶 | 不 | 微 | ||||||
| Ba2+ | 溶 | 溶 | 溶 | 不 | 不 | ||||||
| Cu2+ | 不 | 溶 | 溶 | 不 | 溶 |
查看答案和解析>>
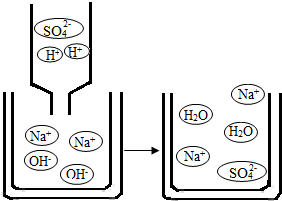
科目:初中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 21、化学调研小组的同学用氢氧化钠和稀盐酸探究中和反应,请你参与以下探究:
21、化学调研小组的同学用氢氧化钠和稀盐酸探究中和反应,请你参与以下探究:
查看答案和解析>>
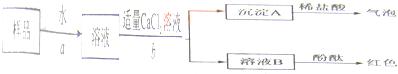
科目:初中化学 来源: 题型:阅读理解
| 实验操作 | 实验现象 | 实验结论 |
| 取少量该溶液于试管中,向溶液中滴加稀盐酸,并不断振荡. | 有气泡冒出. | 氢氧化钠溶液一定变质了. |
| 实验步骤 | 实验现象 | 实验结论 |
| (1)取少量该溶液于试管中,向溶液中滴加过量的氯化钙溶液,并不断振荡. | 有 白色沉淀 白色沉淀 生成. |
说明原溶液中一定有碳酸钠. |
| (2)取步骤(1)试管中的少量上层清液,滴加酚酞溶液. | 溶液变红色. | 说明原溶液中一定有 氢氧化钠 氢氧化钠 . |
查看答案和解析>>
科目:初中化学 来源: 题型:
小明在实验室发现一瓶氢氧化钠固体没有塞上瓶塞,于是他和他的同学一起对这瓶氢氧化钠固体展开探究,请你与他们一起进行探究。
【提出问题】这瓶氢氧化钠固体是否变质?
【查阅资料】CaCl2溶液呈中性。
【猜想与假设】
①氢氧化钠没有变质;②该氢氧化钠部分变质;③该氢氧化钠 。
【设计实验】取氢氧 化钠固体样品溶于水配成溶液A,进行如下实验:
化钠固体样品溶于水配成溶液A,进行如下实验:
| 实验步骤 | 实验现象 | 结论及解释 |
| (1)取少量溶液A于试管中,向其中滴加足量的稀盐酸; | 有气泡产生 | 猜想 不成立 |
| (2)另取少量溶液A于试管中,向其中滴加足量的氯化钙溶液; | 产生 | 反应的化学方程式为: |
| (3)将步骤(2)所得的混合液静置,向上层清液中滴加无色的酚酞溶液。 | 溶液呈红色 | 猜想 成立 |
【反思与交流】
久置的氢氧化钠变质的原因是(用化学方程式表示) ,因此,氢氧化钠应 保存。
【探索与拓展】为进一步探究氢氧化钠的变质程度,小明称取18.6g氢氧化钠固体样品放入烧杯中,向其中逐滴加入稀盐酸,到不再产生气泡为止,共消耗稀盐酸100g,反应后称得烧杯中溶液的质量为114.2g。试计算:
(1)该样品中碳酸钠的质量为 ;
(2)该氢氧化钠的变质程度(即变质的氢氧化钠占变质前的氢氧化钠的质量分数)为
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com