
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 双氧水溶液的 溶质质量分数 | 1% | 3% | 5% | 10% | 15% | 20% | 25% | 30% |
| MnO2 粉末的 质量(克) | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 |
| 收集500 ml气体 所用的时间(秒) | 660 | 220 | 205 | 80 | 25 | 9 | 4 | 3 |
| 反应后溶液的温度(℃) | 24 | 34 | 39 | 65 | 70 | 79 | 85 | 90 |
分析 (1)根据表格中“收集到500mL气体所需时间”分析数据得出结论;
(2)对反应速度影响的因素中还有气压、温度、反应物颗粒大小等;
(3)根据化学方程式结合已知量和未知量计算.
解答 解:(1)从表格中“收集到500mL气体所需时间”可知,H2O2溶液的质量分数越大,收集500mL所需时间越短.就是说有H2O2溶液的质量分数越大反应速率越快;
故答案为:H2O2溶液的质量分数越大反应速率越快;
(2)根据对反应速度影响的因素中还有气压、温度、反应物颗粒大小等.
故答案为:其他条件不变时,改变此反应的温度,可加快此反应的速率(可从温度、催化剂等方面进行猜想);
(3)解:设需要30%的过氧化氢的质量为x,
2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑
68 32
30%x 5L×1.4g/L
$\frac{68}{30%x}$=$\frac{32}{5L×1.4g/L}$ x=49.58g
答:在室温中要收集5L氧气,需要49.58g30%的双氧水溶液;
故答案为:49.58g.
点评 本题通过对比实验结果的分析,找到事物的内在联系,主要考查了学生分析问题的能力,总的来说该题起点高但落点较低.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 序号 | 温度/℃ | 水的质量/克 | 所加硝酸钾的质量/克 | 所得溶液的质量/克 |
| ① | 28 | 10 | 4 | 14 |
| ② | 28 | 10 | 6 | 14 |
| ③ | 60 | 10 | 8 | 18 |
| A. | ①②所得溶液溶质的质量分数相等 | |
| B. | ③所得溶液一定是硝酸钾的饱和溶液 | |
| C. | 28℃时10克水中最多能溶解硝酸钾4克 | |
| D. | 60℃时等质量水中能溶解的硝酸钾比28℃时多 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Fe、X、Cu | B. | X、Fe、Cu | C. | Fe、Cu、X | D. | Cu、X、Fe |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
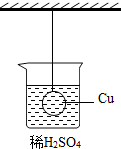 如图所示,一悬挂铜球浸没在稀硫酸溶液中,且铜球不与烧杯接触,现往稀硫酸中投入一铁片,待铁片充分反应后,铜球所受的拉力变化情况是( )
如图所示,一悬挂铜球浸没在稀硫酸溶液中,且铜球不与烧杯接触,现往稀硫酸中投入一铁片,待铁片充分反应后,铜球所受的拉力变化情况是( )| A. | 变大 | B. | 变小 | C. | 不变 | D. | 无法判断 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
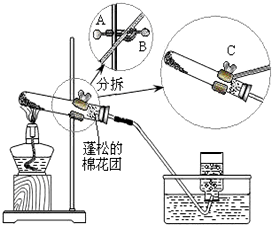 某同学做“高锰酸钾制取氧气”的实验过程如下:
某同学做“高锰酸钾制取氧气”的实验过程如下:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com