
【题目】A、B、C、D、E是初中化学常见的五种不同类别的物质,其中B为红棕色固体,C是胃液的主要成分,E广泛用于玻璃、造纸、纺织和洗涤剂的生产等.它们相互反应及转化关系如图所示,(图中“一”表示相连的两物质间能发生化学反应,“→”表示一种物质能转化为另一物质,部分反应物、生成物及反应条件已略去)。请回答下列问题。
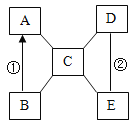
(1)D物质的名称是___________。
(2)反应①的化学方程式为_____。
(3)反应②的现象是_______。
(4)A与C反应的基本反应类型是______。
【答案】氢氧化钙 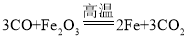 (或H2、C还原Fe2O3) 有白色沉淀产生 置换反应
(或H2、C还原Fe2O3) 有白色沉淀产生 置换反应
【解析】
C是胃液的主要成分,则C为盐酸;B为红棕色固体,且能与盐酸反应,所以B为氧化铁;A既能够与C(盐酸)反应,还能由B(氧化铁)反应生成,则A为铁;E广泛用于玻璃、造纸、纺织和洗涤剂的生产等,则E为碳酸钠;A、B、C、D、E是初中化学常见的五种不同类别的物质,D既能与C(盐酸)反应,还能够与E(碳酸钠)反应,所以D为氢氧化钙。
(1)由分析可知,D为氢氧化钙,故填氢氧化钙。
(2)反应①可以是B(氧化铁)与一氧化碳在高温的条件下反应生成A(铁)和二氧化碳,故反应的化学方程式写为: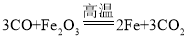 。
。
(3)反应②是D(氢氧化钙)与E(碳酸钙)反应生成氢氧化钠与碳酸钙沉淀,观察到的现象是有白色沉淀产生,故填有白色沉淀产生。
(4)A与C的反应是铁与盐酸反应生成硫化亚铁和氢气,该反应是一种单质与一种化合物反应生成另一种单质与另一种化合物的反应,符合置换反应的特点,属于置换反应,故填置换反应。


科目:初中化学 来源: 题型:
【题目】二氧化碳若合理利用,是一种与水一样重要的原料。
Ⅰ.美国研究人员利用镍和钯作催化剂,将二氧化碳转化为具有多种用途的一氧化碳或甲醇。
(1)该转化属于____(填“物理”或“化学”)变化;其催化剂是两种___(填“金 属”或“非金属”)。
(2)在能源领域,一氧化碳是液态氢的一种重要补充物。氢是一种___(填“化石能源”或“清洁能源”);为减少温室气体排放,可大力开发和利用的新能源还有___(至少一种)。
(3)甲醇(CH3OH)可用作赛车燃料。若其燃烧产物与乙醇相同,则其化学方程式为____。
Ⅱ.日本核灾难后,清洁煤电受到追捧。我国已成功运行燃煤电厂二氧化碳捕集技术,使液态二氧化碳成为最终产品。
(1)以二氧化碳为原料可生产更环保的碳基钾肥,如碳酸钾等。碳酸钾中的阴离子是___(用离子符号表示)。
(2)该技术的重要一步是在低温条件下用化学溶剂吸收烟气中的二氧化碳。控制低温条件的原因是___。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】课本中有如下实验:取4朵用石蕊溶液染成紫色的干燥纸花,分别按下图所示进行实验。请认真观察、思考后,回答下列几个问题。
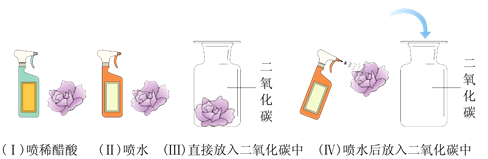
(1)观察到纸花的颜色变化是:
Ⅰ:___________________;
Ⅱ:__________________;
Ⅲ:______________________;
Ⅳ:____________________。
(2)Ⅰ、Ⅱ两项实验说明什么?________________。
(3)设计4个实验,进行对比的目的是什么?由此你可得到哪些结论?________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氯化钠具有广泛的应用。
(1)实验室配制50g溶质质量分数为15%的氯化钠溶液。
①用已调节平衡的托盘天平称取氯化钠时,发现指针偏左,接下来的操作是____________。(填序号)
A 添加氯化钠 B 减少氯化钠 C 调节平衡螺母 D 添加砝码
②在量取水的体积时,若仰视读数,则会导致氯化钠溶液的溶质质量分数____________ (填>、=、<)15%。
(2)探究某氯化钠样品中杂质的成分。
某氯化钠样品中,可能含有硫酸钠、氯化镁、氯化钙中的一种或几种杂质。甲同学的实验探究过程记录如下:
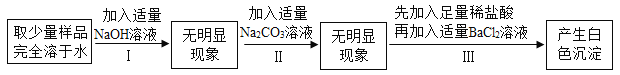
①根据以上实验信息,甲同学得出结论:此氯化钠样品中含有的杂质是____________。
②(实验分析)
a.步骤I中加入适量NaOH溶液的目的是____________。
b.乙同学认为步骤Ⅲ中不需要加入足量稀盐酸,你是否同意他的观点?____________ (选填“同意”或“不同意”),请说明原因____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是甲、乙、丙三种固体物质溶解度曲线图,请回答:
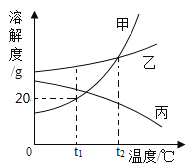
(1)t1°C时,甲物质的溶解度为_______。
(2)乙中含有少量甲,提纯乙的方法是_______。
(3)将等质量的乙、丙两种物质分别配成t1°C时的饱和溶液,所需溶剂的质量较少的是_。
(4)t2°C时,等质量甲、乙、丙三种物质的饱和溶液降温至t1°C,所得溶液质量的关系是_。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】珍爱生命,关注安全。下列做法正确的是
A. 发现煤气泄漏,立即打开吸油烟机排气
B. 不慎将浓硫酸沾到皮肤上,立即用大量水冲洗,再涂上 3%~5%的氢氧化钠溶液
C. 误食重金属盐后,就医前可服用蛋清或牛奶自救
D. 新装修的房屋入住前开窗通风一段时间,防止甲醛等有害物质危害健康
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有A、B、C、D、E、F、G七种不同化合物,它们有如图所示的反应关系(图中的“一”表示相连两物质之间可以发生反应,图中的“→”表示一种物质可以转化为另一种物质,反应条件、部分反应物和生成物己略去)。已知: B和D; C和E; F和G分别为相同类别的物质,A是胃酸的主要成分,D常应用于肥皂,石油,造纸、纺织等工业,F为红色固体。请写出:

(1)F的化学式为______, G物质类别________。
(2)E→C且生成D的化学反应方程式_________。
(3)F→G的化学反应方程式________,其中F在该反应中是_____剂。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】医用双氧水可杀灭肠道致病菌、化脓性球菌,一般用于物体表面消毒。小明同学腿部擦伤,大夫在她伤口上涂了医用过氧化氢溶液,小明看到伤口处产生了小气泡,很好奇。为什么瓶中的过氧化氢溶液涂到伤口上,分解就加快了呢?
(查阅资料)
(1)过氧化氢是人体代谢废物之一,人体存在过氧化氢酶,可以催化过氧化氢分解。
(2)温度对化学反应的快慢有影响,人体正常体温是37℃。
(提出猜想)
猜想1:过氧化氢分解加快是因为体温比瓶中的温度高。
猜想2:过氧化氢分解加快是因为伤口中有过氧化氢酶。
(实验探究)
小明准备用如下图所示装置测定过氧化氢分解的快慢,实验前在注射器中吸入过氧化氢溶液,量筒内装满水,并用排水法。记录2分钟收集的气体体积。
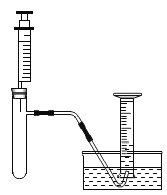
进行实验:
序号 | 实验步骤 | 实验现象 | 实验结论 |
① | 分两次进行实验,均注入5 mL过氧化氢溶液 第一次在常温下进行 第二次将试管浸在37℃的温水中 | 量筒中2分钟收集到的气体体积均为5 mL | (1)__________ |
② | 分两次进行实验,均注入5 mL过氧化氢溶液 第一次向试管中加入一小粒过氧化氢酶,然后浸在37℃的温水中 (2)第二次__________ | 第一次,量筒中2分钟收集到的气体体积为56 mL 第二次,量筒中2分钟收集到的气体体积为5 mL | 过氧化氢分解速率加快是因为过氧化氢酶的作用 |
(3)实验①②中,有三次收集到的气体均为5 mL,若用带火星的木条去检验这5 mL气体,观察到现象是________________。
(4)写出过氧化氢在过氧化氢酶的作用下分解的化学方程式:__________________。
(实验反思)
小明反思了实验过程,认为实验①得出的结论可能存在不足。于是他又查阅资料。科研工作者以10 mL30%的H2O2溶液为样本,加入相同的过氧化氢酶,分别做了如下9组不同的实验,所得如下数据:
序号 | 因素 | O2(ml) | ||
温度 | pH | 浸取时间 | ||
1 | 35 | 6.4 | 6 | 43.7 |
2 | 35 | 6.8 | 8 | 71.6 |
3 | 35 | 7.2 | 10 | 38.4 |
4 | 37 | 6.4 | 6 | 52.3 |
5 | 37 | 6.8 | 8 | 97.6 |
6 | 37 | 7.2 | 10 | 41.2 |
7 | 39 | 6.4 | 6 | 47.4 |
8 | 39 | 6.8 | 8 | 77.4 |
9 | 39 | 7.2 | 10 | 37.7 |
(5)综合分析表中数据,本实验最适宜条件为____组(填序号),影响过氧化氢酶发挥作用的因素有_________。酶对双氧水分解的催化作用受多个因素影响,不仅各个因素独立作用,而且因素之间有联合作用,有时个别因素对酶的抑制较强。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硝酸(HNO3)是实验室常见的一种酸。实验小组对硝酸的某些性质进行研究。
Ⅰ、挥发性
(实验1)取一瓶质量分数为68%的浓硝酸,打开瓶盖,遇潮湿的空气,瓶口可以看到_____,原因是_____。
Ⅱ、不稳定性
(查阅资料1)硝酸是无色液体,见光或受热分解生成红棕色的NO2气体、氧气及一种无色液体
(1)硝酸分解的化学方程式为:_____。
(实验2)取3份浓度和体积均相同的浓硝酸分别放入3支试管中,塞好塞子,放置在室外阳光充足的地方(气温为26℃)。记录溶液上方的气体颜色随时间的变化情况。
实验编号 | ① | ② | ③ |
实验条件 |
|
|
|
实验现象 | 6分钟出现浅红棕色 15分钟红棕色比较明显 30分钟红棕色非常明显 | 60分钟无明显变化 | 3分钟出现浅红棕色 6分钟红棕色比较明显 10分钟红棕色非常明显 |
(2)实验①、②对比是研究_____对浓硝酸稳定性的影响。
(3)实验①、③对比可得出的结论是_____。
Ⅲ、酸性
(查阅资料2)硝酸能够与金属氧化物反应生成盐和水。
(实验3)向氧化铜粉末中加入硝酸,能够看到的现象是_____。
IV、氧化性
(查阅资料3)浓硝酸在加热条件下能与木炭发生反应:
C+4HNO3(浓)![]() 4NO2↑+CO2↑+2H2O。
4NO2↑+CO2↑+2H2O。
(实验4)如图所示,将红热的木炭伸到浓硝酸上方,观察到有红棕色气体产生。请解释生成该红棕色气体的原因可能是_____。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com