
【题目】下图是元素周期表中的一格,依据图中的信息得到的下列认识错误的是( )

A.该元素原子的质子数为14 B.该元素属于非金属元素
C.该元素一个原子的原子核外有14个电子 D.该元素的核电荷数为28.09
【答案】D
【解析】
元素周期表中的每一个方格,左上角的数字表示原子序数为14,右上角的符号表示元素符号为Si,中间的汉字表示元素名称为硅,最下边的数字是该元素原子的相对原子质量为28.09。
A. 元素周期表中的原子序数是按照核电荷数(即质子数)递增的顺序排列的,所以原子序数=核电荷数=质子数=14,所以该元素原子的质子数为14。故A不符合题意;
B. 该元素的名称 “硅”为“石”字旁,属于非金属元素。故B不符合题意;
C. 由原子结构可知,一般情况下,在原子中,核电荷数=质子数=核外电子数=原子序数,该元素的原子序数为14,所以它的原子核外有14个电子。故C不符合题意;
D. 由以上分析可知,元素方格中最下边的数字表示该元素的相对原子质量为28.09,而不是核电荷数为28.09。故D符合题意。
故选D。


科目:初中化学 来源: 题型:
【题目】某实验小组对不同条件下的硝酸钾的溶解情况进行实验探究,在甲乙丙三个烧杯中放入![]() 硝酸钾晶体,再分别加入
硝酸钾晶体,再分别加入![]() 冷水、热水与酒精,充分搅拌后(保持各自的温度不变),结果如图
冷水、热水与酒精,充分搅拌后(保持各自的温度不变),结果如图![]() 所示。
所示。
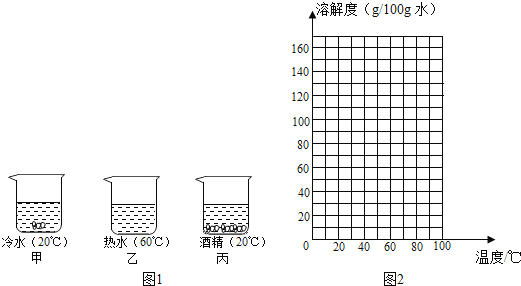
(1)甲烧杯中溶液是_____(填“饱和”或“不饱和”)溶液。
(2)由以上实验可得出结论:影响物质溶液度的因素有_____、_____。
(3)将乙烧杯中的溶液降温到t1℃时,硝酸钾溶液恰好饱和,则t1℃时的溶解度是_____。再往乙烧杯中加入10mL水,改变温度至t2℃时,溶液又恰好达到饱和状态,则t1_____t2(填“>”、“<”或“=”)。
(4)经实验测定,获得不同温度时硝酸钾的溶解度数据。
温度 | 溶解度(g/100g水) |
20 | 31.6 |
40 | 63.9 |
50 | 145 |
60 | 110 |
70 | 140 |
80 | 169 |
请根据表中的数据,在图![]() 坐标图中描点、绘制符合硝酸钾溶解度变化规律的曲线_____。
坐标图中描点、绘制符合硝酸钾溶解度变化规律的曲线_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】电石是一种重要的化工原料,极易与水反应:CaC2+2H2O=Ca(OH)2+C2H2↑。将电石长期露置于空气中,会发生下列变化:电石(CaC2)![]() 灰浆→残渣。
灰浆→残渣。
(1)残渣中的主要成分是Ca(OH)2和_____(写化学式)。
(2)工业上利用电石制备某化工原料的流程如下(注:加入NH4Cl溶液的目的是溶解残渣中的难溶盐):
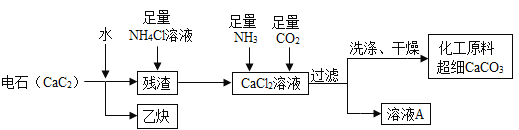
①流程中溶液A可循环使用,溶液A中的主要成分的化学式是_____。
②检验沉淀是否洗涤干净的实验方案:_____,则证明洗涤干净。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学为验证炭在氧气中不完全燃烧的产物既有CO又有CO2, 设计如图所示:
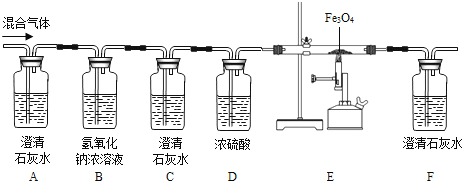
流程进行实验,根据所学知识回答相关问题.
(1)按上面连接好装置,在装入药品之前,必须进行的操作是________;
(2)B装置中NaOH浓溶液的作用是________;
(3)实验开始时,必须先通入混合气体一段时间再点燃酒精喷灯加热,目的是________;
(4)根据设计意图,观察到________(填写实验现象)时,证明混合气体中既有CO有CO2;
(5)写出E中的反应化学方程式:________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】对销售的化肥,国家有明确的质量要求。某兴趣小组对市售的某钾肥进行了检测,称取2.0g样品放入烧杯中,加入适量的水溶解后,逐滴加入10%的BaCl2溶液,产生沉淀的质量与所加入BaCl2溶液质量的关系如图1所示(假定杂质不参加反应)。
已知:K2SO4+BaCl2═BaSO4↓+2KC1。

(1)20.8g BaCl2溶被中所含溶质的质量为_____g。
(2)通过计算,判断该钾肥中K2SO4的质量分数是否符合图2的包装说明________?(写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2020年初全球发生了新冠状病毒肺炎疫情,绝大多数公共场所需要消毒。消毒与清洁对公共场所和家庭是至关重要,需要如二氧化氯(ClO2)、漂白剂(有效成分是 NaClO)、酒精(C2H5OH))、洁厕灵(有效成分是盐酸)等药物。
(1)二氧化氯(ClO2)可作水处理消毒剂,二氧化氯中氯元素的化合价是________(用化学符号和数字表示)。
(2)钠离子的结构示意图:_______,由钠原子构成的物质的化学式_____。
(3)酒精(乙醇)中碳、氢、氧元素的质量比为______。
(4)“洁厕灵”与“漂白剂”不能混用,二者若混合易产生一种有毒气体氯气。反应理为: NaClO+2HCl=NaCl+Cl2↑+H2O,根据化学方程式进行计算,“洁厕灵”与“漂白剂”混用若产生了142克Cl2,则消耗了多少克NaClO?_____
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示A~F是初中化学常见的物质,图中“→”表示转化关系,“一”表示能相互反应,反应条件、部分反应物和生成物已省略。已知A~F均含同一种元素,A、D、E、F为四种不同类型的化合物,A为红棕色固体,B常温下为无色液体。请回答下列问题:
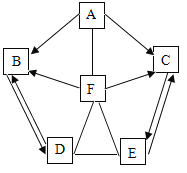
(1)A和F发生反应的基本反应类型为_______。
(2)D的化学式为_______。
(3)D、E发生化学反应时的化学方程式可能为______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】胃液中含有盐酸,常用碳酸氢钠片或铝碳酸镁片治疗胃酸过多症。某化学兴趣小组通过模 拟实验和数字实验探究碳酸氢钠、铝碳酸镁治疗胃酸过多症的优缺点。
(查阅资料)A.铝碳酸镁片主要成分的化学式为[Al2Mg6(OH)16CO3·4H2O] B.抗酸原理:抗酸药物中的离子和胃酸中的氢离子反应,降低胃液酸性。
I.(模拟实验) 定性探究碳酸氢钠和铝碳酸镁与“胃酸”的反应 取甲、乙两个大小相同的锥形瓶,瓶内分别加入 40 mL 同浓度的稀盐酸并在瓶口套有相同大小的气球(其中甲瓶气球内放 1.0 g 碳酸氢钠片,乙瓶气球内放 1.0 g 铝碳酸镁片),同时将气球内的 药品放入锥形瓶,充分反应后,现象如图 1 所示。
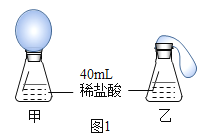
(1)写出碳酸氢钠治疗胃酸过多的化学方程式:__________ 。
(2)铝碳酸镁治疗胃酸过多时发生的反应为:Al2Mg6(OH)16CO3·4H2O + 18HCl ═ 2X + 6MgCl2 + CO2↑ + 21H2O, 则 X 的化学式为________。铝碳酸镁片中含有铝离子、镁离子、氢氧根离子和碳酸根离子。结合上述化学方程式分析,该药物起抗酸作用的离子是______(填离子符号)。
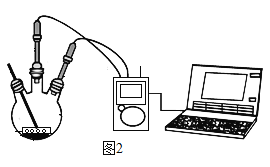
II.(数字实验) 定量探究碳酸氢钠片、铝碳酸镁片与“胃酸”的反应,对比分析两种药片产生CO2的速率快慢和中和酸的能力强弱。取两只 500 mL 规格烧瓶,分别加入 120 mL 稀盐酸并插入 pH 传感器,启动磁力搅拌器和传 感器然后分别投入 1.0 g 碳酸氢钠片和 1.0 g 铝碳酸镁片(如图 2 所示),利用数字化实验分别测 定碳酸氢钠片、铝碳酸镁片与“胃酸”反应时,产生CO2的速率快慢和 pH 的变化,处理所得数据, 得到“二氧化碳浓度-时间”曲线(如图 3 所示)和“pH-时间”曲线(如图 4 所示)。
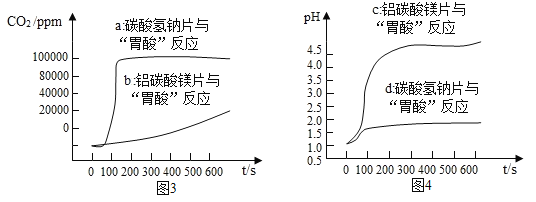
分析曲线图 3、图 4,回答下列问题:
(3)分析图 4,所用稀盐酸的 pH 约为__________;
(4)结合图 3,描述图 1 中乙装置的实验现象是:__________。
(5)相比铝碳酸镁,服用碳酸氢钠治疗更易引发胃胀的原因是:_______。
(6)判断铝碳酸镁片中和酸的能力更强的理由是____________。
(反思与提升)
(7)患有胃溃疡的病人不易过多服用含________ 的药物,以免造成胃胀、引发胃穿孔等症状。 日常生活中,我们应该根据个人的实际病情,遵照医嘱或按药物说明书,选择适合的胃药服用。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学是以实验为基础的科学,实验是科学探究的重要手段。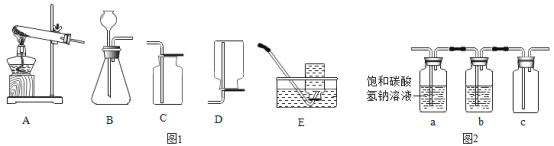
(1)图1中铁质仪器的名称是:_____。
(2)A装置试管口需要放一团棉花,请写出A装置制取氧气的化学方程式:_____,该反应属于_____(填写基本反应类型)。
(3)选择图中的装置制取CO2,选用的发生装置是_____;收集CO2时不适用D装置,原因是_____。
(4)为得到纯净干燥的CO2,将实验室中制得的CO2依次通过如图2装置。
①装置a的作用:_____。
②装置b内装的药品是:_____(填物质名称)。如果把装置a和b位置颠倒,将会引起的后果是_____。
③将点燃的镁条伸进集满CO2的集气瓶c中,镁条剧烈燃烧,瓶内有白色和黑色两种固体物质生成,通过该实验你得到的一点启发是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com