
【题目】盐酸、硫酸、烧碱、熟石灰等都是重要的化工原料,在生产和生活中有着重要的应用。
(1)浓硫酸和烧碱固体都可以做某些气体的干燥剂,是因为它们有_____性。
(2)人体胃液中含有的酸是_____,用来改良酸性土壤的碱是_____。
(3)炉具清洁剂中含有_____,它可与油脂反应,从而去除去油污;除锈剂中含有_____,除锈的化学方程式为_____。
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:初中化学 来源: 题型:
【题目】下图所示的四个图像,分别对应四种过程,其中正确的是( )

A. ①分别向等质量Mg和Cu中加入足量等质量、等浓度的稀硫酸
B. ②分别向等质量且足量的Zn中加入等质量、不同浓度的稀硫酸
C. ③分别向等质量且足量的Mg和Zn中加入等质量、等浓度的稀硫酸
D. ④分别向等质量的Mg和Zn中加入等质量、等浓度且足量的稀硫酸
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属钛(Ti)因具有许多神奇的性能而越来越引起人们的关注,被誉为“未来金属“。常温下钛不和非金属、强酸反应,加热至红热时,能与常见的非金属反应。工业上由钛铁矿(主要成分为FeTiO3)制取金属钛的主要工艺过程如图:
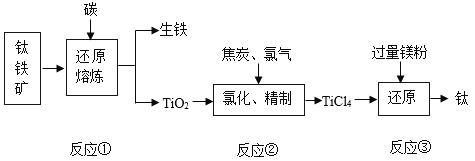
(1)反应前将钛酸亚铁和焦炭磨成粉末状的原因是_____。
(2)TiO2与C、Cl2在高温下反应,生成TiCl4和一种有毒气体,该气体是一种氧化物,其化学式为_____。
(3)写出步骤③中(Ar起保护气作用)在高温时生成金属钛的化学反应方程式_____,该反应的基本类型为_____。
(4)今年来,工业上用电解熔融的TiO2来制取金属钛获得成功,从能量的角度分析,工业利用该方法制备金属Ti的缺点是_____。
(5)如何从反应③后的固体中获得金属钛:_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】Na2CO3在工业和生活中有重要的作用。它的来源主要有以下两种途径:
I.将制碱与制氨结合起来的联合制碱法。这个方法是由我国的制碱工业先驱_发明的。
A 张青莲
B 道尔顿
C 侯德榜
D 华罗庚
Ⅱ.自然界有很多咸水湖,人们通过“冬天捞喊,夏天晒盐”的方式获得湖盐,其中就含有Na2CO3。
(1)小明同学想对某夏天制得的湖盐样品成分进行探究,查阅资料后他对样品成分做出了三种猜想。
猜想一:NaCl、Na2CO3
猜想二:NaCl、Na2SO4;
猜想三:NaCl、Na2CO3、Na2SO4请帮助他完成如下实验:
实验操作 | 实验现象 | 实验结论 | |
实验一 | 取少量样品于试管中,加适量水溶解后,加入过量稀HNO3 | 产生能使澄清石灰水变浑浊的气体 | 猜想___不成立 |
实验二 | 向实验一所得的溶液中加入适量的________ | __ | 猜想三成立 |
(2)小明同学为进一步确定上述湖盐样品中Na2CO3 的质量分数,取该湖盐样品10.0g做了如图所示的补充实验。(注:所用药品均足量)
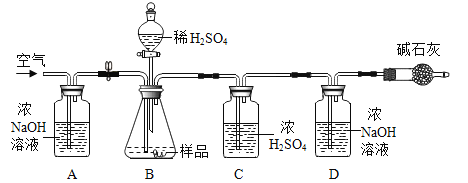
①反应结束之后打开止水夹并通入空气的目的是____。
②装置D中发生的反应为____(用化学方程式表示)。
③实验中碱石灰(含氧化钙和氢氧化钠)的作用是___。
④实验结束后,测得装置D增重0.33g,则该湖盐样品中Na2CO3的质量分数为多少___?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具。下面是元素周期表中1~18号元素原子核外电子排布:请回答下列问题:
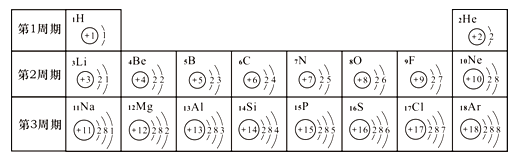
①第17号元素属于_____元素(填“金属”或“非金属”),其次外层电子数为 ______。
②元素的化学性质与原子结构中的 ______________数关系密切;在同一族中,各元素的原子结构呈现的规律有 _______________(任写一点)。
③地壳中含量最多的金属元素与含量最多的非金属元素组成的化合物为 _______。第16号元素在化学反应中容易形成 _________(填离子符号),该元素的单质在氧气中燃烧的现象是__________ 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示,试管中盛有一段镁条,向试管中加入过量稀盐酸,观察到U形管中a处液面下降,b处液面上升。回答下列问题:
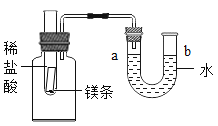
(1)镁条与稀盐酸反应的化学方程式为_____。
(2)U形管中液面发生变化的原因是_____。
(3)将试管中的物质换成水和另一种固体,可以让U型管内产生同样现象,则“另一种固体”是_____;若U型管内b处液面下降,a处液面上升,则“另一种固体”是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两种固体物质的溶解度曲线如图所示,据图判断下列说法不正确的是( )
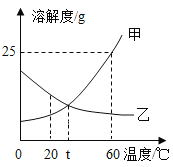
A.20℃时,甲物质的溶解度小于乙物质的溶解度
B.甲物质的溶解度随温度的升高而增大
C.t℃时,甲和乙的饱和溶液的溶质质量分数相等
D.将60 ℃时的甲、乙的饱和溶液降温至t ℃,甲、乙的溶液中均有晶体析出
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】回答下列问题。
(1)“侯氏制碱法”制备Na2CO3的流程如下。
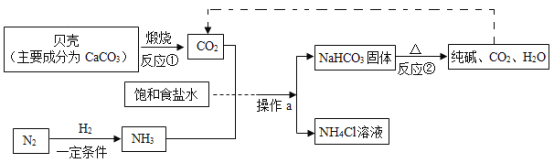
①反应②的化学方程式是___。
②操作a的名称是__,实验室进行此操作所需的主要玻璃仪器有烧杯、玻璃棒和____。
③流程图中能循环利用的物质是_(填化学式) ,副产品为_ ( 填化学式)。
(2)实验室制备纯碱( Na2CO3 )的主要步骤为:将饱和NaCl溶液倒入烧杯加热,控制30~35°C,搅拌下分批加入研细的NH4HCO3固体,加料完毕,保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质、抽干,转入蒸发皿中灼烧得Na2CO3固体。
四种盐在不同温度下的溶解度表( g/100g水)
温度 溶解度 | 0°C | 10° C | 20° C | 30° C | 40° C | 50° C | 60°C | 100°C |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | 一 | 一 | 一 | 一 |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 16.4 | 一 | |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
①反应温度需要控制在30~ 35°C ,原因是__。为控制此温度,通常采取的加热方法为___。
②保温30分钟,静置后只析出NaHCO3晶体的原因__。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学为了探究相关金属的化学性质,做了下列实验:

(1)A试管中实验现象是_____。
(2)只通过A和B实验尚不能证明铜、银两种金属的活动性强弱,需补充一个实验来证明,补充实验所用试剂不合理的是_____。
A Cu、Ag、稀盐酸 B Cu、AgNO3溶液 C Cu(NO3)2溶液、Ag
(3)实验C中物质充分反应后,某同学对试管中固体的成分提出以下四种猜想:
A Zn、Cu、Ag B Zn、Cu C Cu、Ag D Ag
这四种猜想中你认为有可能的是_____(填编号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com