
 化学兴趣小组的同学们用下列药品探究影响金属与酸反应速率的因素.装置中产生氢气的量可以用压强传感器测出(在等温条件下,产生氢气体积与装置内压强成正比.反应放热忽略不计)
化学兴趣小组的同学们用下列药品探究影响金属与酸反应速率的因素.装置中产生氢气的量可以用压强传感器测出(在等温条件下,产生氢气体积与装置内压强成正比.反应放热忽略不计)分析 (1)要熟悉各种仪器的名称、用途和使用方法;
(2)镁和稀盐酸反应生成氯化镁和氢气;
(3)根据盐酸的浓度不同分析解答;
(4)根据氢氧化钠能与盐酸反应解答;
(5)根据最终生成氢气的质量相等解答;
(6)分局所用金属的纯度不同、金属的种类不同解答;
(7)根据影响金属与酸反应速率的因素可能是温度解答,设计实验时要注意控制变量.
解答 解:(1)a仪器的名称是锥形瓶;故填:锥形瓶;
(2)镁和盐酸发生反应的化学方程式为 Mg+2HCl=MgCl2+H2↑;故填:Mg+2HCl=MgCl2+H2↑;
(3)相同的纯锌片与不同浓度的稀盐酸反应,该实验要控制的变量还有温度和锌片的质量;从图中可以看出:盐酸浓度越大,反应程度越剧烈;故填:锌片的质量;盐酸浓度越大,反应程度越剧烈;
(4)氢氧化钠能与盐酸反应,故用稀盐酸与活泼金属反应制取氢气混入氯化氢气体时,可以将生成的气体通入氢氧化钠溶液就可以除去混入的该气体;故填:氢氧化钠;
(5)足量的相同颗粒大小的纯锌片、粗锌片、镁条分别与5毫升10%的稀盐酸反应,从图中可以看出,盐酸完全反应后,生成氢气的质量相等;故填:盐酸完全反应后,生成氢气的质量相等;
(6)图丙实验中,所用的金属的纯度不同、金属的种类不同,故可以看出影响金属与酸反应速率的因素有金属的纯度、金属的种类;故填:金属的纯度;金属的种类;
(7)影响金属与酸反应速率的因素可能是温度,可以取同样的金属镁,与同样的足量的稀盐酸分别放入装置甲中,其中一个装置放入80℃的水浴装置中;用压强传感器测出装置内产生氢气的量,然后得出结论;
故填:温度;
实验步骤:把质量相同、形状相同的镁片、足量的质量分数相同的稀盐酸分别放入装置甲中,其中一个装置放入80℃的水浴装置中;
实验现象:单位时间内,水浴装置中的反应产生的压强大;
实验结论:温度越高,反应速率越快.
点评 本考点主要考查了影响金属与酸发生化学反应速率的因素的探究,还考查了在生产、生活及实验中应注意的问题,从酸的浓度、金属的活动性和金属的状态等不同的角度,设计实验,也考查了学生的实验设计能力.要认真分析,综合把握,问题就会迎刃而解.本考点主要出现在实验题中.


 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
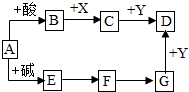 如图是初中化学中常见物质的转化关系(反应条件和部分产物已略去),其中A为钠盐,X、Y均为黑色粉末,D为红色金属单质,F在常温下为液态.试回答下列问题.
如图是初中化学中常见物质的转化关系(反应条件和部分产物已略去),其中A为钠盐,X、Y均为黑色粉末,D为红色金属单质,F在常温下为液态.试回答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 把实验剩余的药品倒入废液缸 | |
| B. | 用药匙取用食用盐,再用同一药匙直接取用碳酸钠粉末 | |
| C. | 取用较多量液体药品时,可直接向试管中倾倒 | |
| D. | 向试管中倾倒液体时,试管要直立 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验 编号 | 温度 | 盐酸 浓度 | 铝片消失的时间/s |
| ① | 20℃ | 5% | 60 |
| ② | 20℃ | 10% | 42 |
| ③ | 40℃ | 10% | 30 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| MnO2用量(克) | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 | 0.9 | 1.0 |
| 所用时间(秒) | 17 | 8 | 7 | 5 | 4 | 3 | 2 | 2 | 2 | 2 |
| 实验次序 | H2O2溶液溶质质量分数 | MnO2粉末用量(克) | 收集540mL气体所用时间 | 反应后液体温度(℃) |
| 1 | 1% | 0.2 | 660秒 | 24 |
| 2 | 3% | 0.2 | 220秒 | 34 |
| 3 | 5% | 0.2 | 205秒 | 39 |
| 4 | 10% | 0.2 | 80秒 | 56 |
| 5 | 15% | 0.2 | 25秒 | 65 |
| 6 | 20% | 0.2 | 9秒 | 67 |
| 7 | 25% | 0.2 | 4秒 | 69 |
| 8 | 30% | 0.2 | 3秒 | 70 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 硬水 | B. | 自来水 | C. | 蒸馏水 | D. | 矿泉水 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
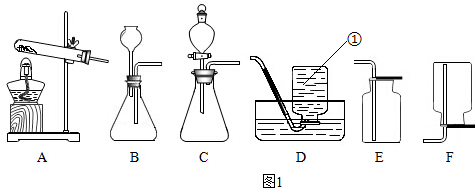
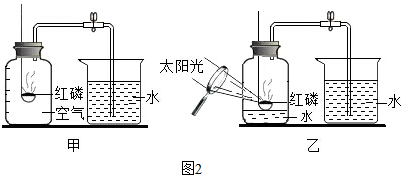
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com