
| 实验 编号 | 温度 | 盐酸 浓度 | 铝片消失的时间/s |
| ① | 20℃ | 5% | 60 |
| ② | 20℃ | 10% | 42 |
| ③ | 40℃ | 10% | 30 |
分析 (1)铝在常温下能和氧气反应,在表面形成一层致密的氧化铝薄膜,铝和盐酸反应生成氯化铝和氢气,可以据此完成解答;
(2)比较表格中的相同量和不同量即通过控制变量法可以完成该题的解答;
(3)根据反应中生成的气体的速率判断反应的速率;
(4)铝片的表面积也能够影响反应速率,可以据此进行解答.
解答 解:(1)铝在常温下能和氧气反应,在表面形成一层致密的氧化铝薄膜,阻止了铝与稀盐酸接触,从而没有打磨的铝片和稀盐酸反应慢;铝和盐酸反应生成氯化铝和氢气,该反应的化学方程式为:2Al+6HCl═2AlCl3+3H2↑;故填:铝在常温下能和氧气反应,在表面形成一层致密的氧化铝薄膜,阻止了铝与稀盐酸接触;2Al+6HCl═2AlCl3+3H2↑;
(2)比较表格中的相同量和不同量可以知道,①和②相同的是温度,不同的是稀盐酸的浓度,即该实验探究的是稀盐酸的浓度对反应的影响;②和③相同的是盐酸的浓度,不同的是溶液浓度,所以探究的是溶液的温度对反应速率的影响,从该组对比实验中可以判断反应溶液的温度越高反应越快;故填:稀盐酸的浓度对反应的影响;溶液的温度对反应速率的影响;反应的温度越高反应越快;
(3)除了用铝片消失的时间来衡量反应的快慢,还可以根据反应中冒出的气体的速率判断反应的速率;故填:反应中冒出的气体的速率;
(4)将稀盐酸换成稀硫酸继续实验,发现铝丝和稀硫酸反应现象不明显,要向证明是Cl-的存在使酸和铝的反应容易进行,可以在稀硫酸中加入一定量的氯化钠,观察产生气泡的速率,故填:取两支试管,分别加入相同的铝丝,然后分别加入等量的稀硫酸,在其中一支试管中加入一定量的氯化钠溶液,观察到加入氯化钠的试管中产生气泡的速度大,说明Cl-的存在使酸和铝的反应容易进行.
点评 本题主要考查了化学方程式的书写及其正确分析实验探究的内容,要根据金属的纯度越高反应速率越快和盐酸的浓度越高反应速率越快分析.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 化学兴趣小组的同学们用下列药品探究影响金属与酸反应速率的因素.装置中产生氢气的量可以用压强传感器测出(在等温条件下,产生氢气体积与装置内压强成正比.反应放热忽略不计)
化学兴趣小组的同学们用下列药品探究影响金属与酸反应速率的因素.装置中产生氢气的量可以用压强传感器测出(在等温条件下,产生氢气体积与装置内压强成正比.反应放热忽略不计)查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
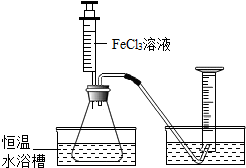 FeCl3溶液对过氧化氢的分解起催化作用,某小组拟在相同浓度FeCl3溶液的催化下,探究过氧化氢浓度对过氧化氢分解速率的影响.
FeCl3溶液对过氧化氢的分解起催化作用,某小组拟在相同浓度FeCl3溶液的催化下,探究过氧化氢浓度对过氧化氢分解速率的影响.| 序号 | H2O2溶液的体积/mL | H2O2溶液的浓度/% | 2%FeCl3溶液的体积/mL | 反应的时间/min | 生成O2的体积m/L |
| 1 | 10 | 30 | x | 5 | V1 |
| 2 | 10 | 15 | 3 | y | V2 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
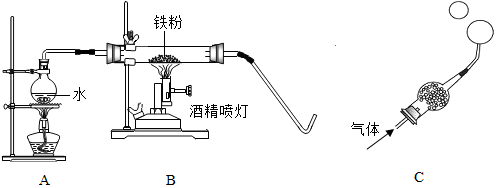
| 常见铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
| 颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
| 能否被进磁铁吸引 | 否 | 否 | 能 |
| 能否与盐酸反应 | 能 | 能 | 能 |
| 实验操作 | 实验现象及结论 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com