
【题目】硫化氢(H2S)是一种有毒气体,其密度比空气的密度大,且能溶于水形成氢硫酸。实验室通常用块状固体硫化亚铁(FeS)和稀硫酸混合,在常温下通过发生复分解反应制得硫化氢气体和硫酸亚铁。试回答:
(l)实验室制取硫化氢的化学反应方程式为:_____。
(2)根据装置图回答下列问题:
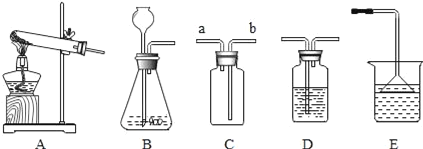
①制取硫化氢气体的发生装置可以选用_____。
②若用C装置收集硫化氢气体,进气口应为_____。
③为了验证硫化氢的水溶液呈酸性,可以将该气体通入装置D,D中所盛的试剂应该是_____,现象是_____。
 小题狂做系列答案
小题狂做系列答案科目:初中化学 来源: 题型:
【题目】生石灰的主要成分是氧化钙,与水反应生成氢氧化钙并放出大量的热。室温时,将生石灰加入饱和石灰水中,生石灰对溶解影响的判断(参照如图溶解度曲线),错误的是( )
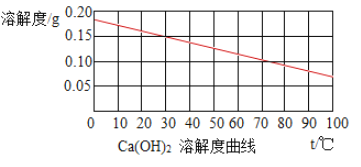
A. 反应中,石灰水始终是饱和溶液
B. 反应中,氧氧化钙的溶解度增大
C. 反应后,溶液的质量减小
D. 反应后,恢复至室温时,溶液的质量分数不变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】20℃时,将等质量的m、n两种固体,分别加入到盛有100g水的烧杯中,充分搅拌后,再升温到50℃时,现象如图甲,m、n两种固体的溶解度曲线如图乙。下列说法正确的是( )
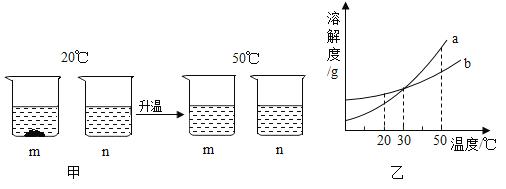
A.图乙中a表示m的溶解度曲线
B.图甲20℃溶液中溶质的质量分数m大于n
C.图甲50℃时的m、n溶液不一定是不饱和溶液
D.30℃时,a、b溶液溶质质量分数不相等
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两种物质的溶解度曲线如图所示,请回答下列问题。
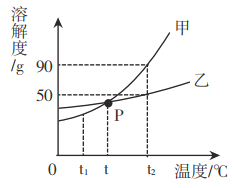
(1)t2℃时,乙物质溶解度是________________g。
(2)P点的意义是________________。
(3)t2℃时,将30g甲物质和乙物质分别加入到50g水中充分溶解,形成饱和溶液的是_____________(填“甲”或“乙”)。
(4)若甲物质中含有少量的乙物质,要提纯甲物质应进行________________(填“降温结晶”或“蒸发结晶”)。
(5)分别将甲、乙两种物质的等质量的饱和溶液从t2℃降温至t1℃,所得溶液的溶质质量分数:甲___乙(填“>”或“<”或“=”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】与以下四个变化过程对应的四个图象中,错误的是( )

A.一定量的饱和石灰水中加入一定量的氧化钙,溶液质量与加入后时间的关系
B.向pH=1的溶液中加水
C.两杯等质量足量的稀硫酸中分别加入等质量的镁、铝,溶液质量与时间的关系
D.t℃时,在一定量的氯化钠不饱和溶液中不断加入氯化钠固体
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国化工专家侯德榜发明了侯氏制碱法,为世界制碱工业作出了突出贡献。
(1)主产品Na2CO3的俗名是_____,副产品氯化铵中阳离子符号为_____。
(2)在实际生产中,产品Na2CO3中常混有少量的NaCl,现有样品11.0 g,将其放入干净的烧杯中,向烧杯中滴加入溶质质量分数为7.3%的稀盐酸,反应后烧杯中物质的质量与滴入稀盐酸的质量关系如图所示。
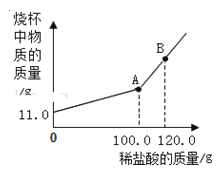
①图中A点表示_____,B点的溶质为_____。
②计算样品中Na2CO3的质量分数(计算结果精确至0.1%)_____
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属和我们的关系很密切,它广泛地存在和应用于生产、生活等各个领域。
(1)下图为我们提供了金属铝、金属铁两种元素在元素周期表中的一些相关信息。
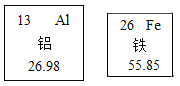
①铁原子核内的质子数为________________;
②铁元素相对原子质量为___________;
③铝的原子结构示意图为____________。
(2)乐乐兴趣小组在实验室进行实验探究:他们将两根完全相同的铝丝分别伸入到稀盐酸和稀硫酸中,观察发现铝丝产生气泡的快慢很是不同。
(提出问题)影响铝和酸反应速率的因素有哪些?
(大胆猜想)I.温度:
Ⅱ._______________:
Ⅲ.酸的种类。
(实验设计)为了验证猜想Ⅱ是否正确,乐乐兴趣小组的同学们进行了如下的实验探究。
实验步骤 | 实验观象 | 实验结论 |
打磨两根型号完全相同的铝丝,分别放入两支相同的试管中,再分别向其中倒入同体积、但不同浓度的稀盐酸 | ________________ | 酸的浓度越大,反应速率越快。 |
①上述反应的化学方程式为____________:
②使用铝丝前打磨的原因是___________。
③对铁质零件进行“发蓝”处理也是一种常用的防锈措施,因能在其表面形成致密氧化膜。若将该零件浸泡于硫酸铜溶液中,发现零件表面出现红色物质,便可以断定该铁质零件的“发蓝”处理效果不佳,原因是__________________。
(3)高铁的迅速发展对钢轨的需求量越来越大,质量要求越来越高。在工业上,经常用“铝热反应”原理来焊接钢轨,原理就是利用铝和氧化铁在高温条件下发生剧烈反应得到熔融的金属,其反应化学方程式为_____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某混合溶液含有一定量的硝酸银、硝酸铜和硝酸钡,为逐一分离其中的金属元素,所加试剂均过量,且理论上氢氧化钠的消耗量最少。所加试剂1-3顺序正确的是
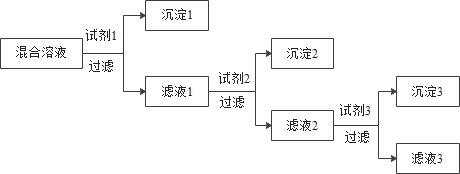
A.氢氧化钠、氯化钠、硫酸钠B.氯化钠、氢氧化钠、硫酸钠
C.氯化钠、稀硫酸、氢氧化钠D.硫酸钠、氯化钠、氢氧化钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com