
【题目】制备波尔多液。
某农场需要大量的波尔多液,农场工人就地取材,利用农场废弃的铜渣(只含有铜和一定量的铁),化工厂的废硫酸和农场附近山上的石灰石来制作波尔多液。下面是制作波尔多液的工艺流程图(注:所加试剂及操作均省略):
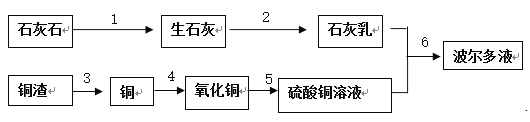
请据图回答下列问题:
(1)写出上述流程1~6中发生化学变化的化学反应方程式:
1______________________。
2______________________。
3______________________。
4______________________。
5______________________。
6______________________。
其中属于复分解反应的是_____________(填流程图中的数字编号)。
(2)喷洒波尔多液后,果农的手上和衣服上会残留一些用水洗不掉的蓝色斑点,这些蓝色斑点属于________(填“酸”、“碱”、“盐”或“氧化物”),在家中洗去衣服上蓝色斑点的是方法是___________________________________。
【答案】CaCO3![]() CaO +CO2↑ CaO+ H2O=Ca(OH)2 H2SO4+Fe=FeSO4+H2↑ 2Cu+O2
CaO +CO2↑ CaO+ H2O=Ca(OH)2 H2SO4+Fe=FeSO4+H2↑ 2Cu+O2![]() 2CuO CuO+H2SO4=CuSO4+H2O Ca(OH)2 +CuSO4=Cu(OH)2↓+CaSO4 ⑤⑥ 碱 用食醋浸泡后用水冲洗
2CuO CuO+H2SO4=CuSO4+H2O Ca(OH)2 +CuSO4=Cu(OH)2↓+CaSO4 ⑤⑥ 碱 用食醋浸泡后用水冲洗
【解析】
1、高温煅烧石灰石反应原理:CaCO3![]() CaO +CO2↑符合“一变多”,属于分解反应;
CaO +CO2↑符合“一变多”,属于分解反应;
2、生石灰与水反应:CaO+ H2O=Ca(OH)2 符合“多变一”,属于化合反应;
3、铜渣中含有少量铁,用稀硫酸将铁除去:H2SO4+Fe=FeSO4+H2↑ 符合“单质+化合物=新单质+新化合”,属于置换反应;
4、铜加热变为氧化铜:2Cu+O2![]() 2CuO符合“多变一”,属于化合反应;
2CuO符合“多变一”,属于化合反应;
5、氧化铜与硫酸反应原理:CuO+H2SO4=CuSO4+H2O,符合“化合物+化合物=新化合物+新化合物”,反应物离子交换成分,属于分解反应;
6、氢氧化钙与硫酸铜反应原理:Ca(OH)2 +CuSO4=Cu(OH)2↓+CaSO4符合“化合物+化合物=新化合物+新化合物”,反应物离子交换成分,属于分解反应;
其中属于复分解反应的是:⑤⑥;
(2)喷洒波尔多液后,果农的手上和衣服上会残留一些用水洗不掉的蓝色斑点,这些蓝色斑点是氢氧化铜,属于碱性物质,在家中洗去衣服上蓝色斑点的是方法是:用食醋浸泡后用水冲洗;


科目:初中化学 来源: 题型:
【题目】甲、乙、丙为初中化学常见物质,其转化关系如下图所示(“→”表示由一种物质转化成另 一种物质,反应条件、部分反应物和生成物已略去)。
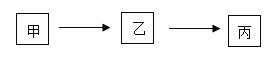
(1)若甲、乙、丙为稀硫酸、氢氧化铜、硫酸铜中的一种,写出乙到丙的化学方程式_____。
(2)若甲、乙、丙均为含有钙元素的化合物,丙中钙元素的质量分数为 40%,甲与水反应生 成乙并放出大量的热,则乙→丙的化学方程式为_____,丙的用途为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某小组同学设计并进行实验,探究影响过氧化氢分解速率的因素。(实验装置如图所示,夹持仪器已略去)
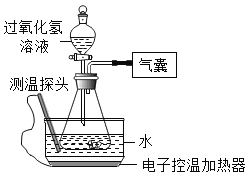
(猜想与假设)
影响过氧化氢分解速率的因素可能有温度、溶液的浓度、催化剂用量。
(实验记录)
同学们进行6组实验,实验记录如下:
实验序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
过氧化氢溶液的 浓度(%) | 30 | 30 | 15 | 30 | 30 | 30 |
过氧化氢溶液的 体积(mL) | 6 | x | 6 | 6 | 6 | 6 |
水槽中水的温度 | 20 | 90 | 70 | 70 | 20 | 20 |
锥形瓶中的物质 | 0.1g MnO2 | 0.5g MnO2 | ||||
6min内产生氧气(mL) | 0.0 | 41.0 | 4.5 | 12.1 | 2.0 | 650.0 |
(解释与结论)
(1)实验②中应加入过氧化氢溶液的体积x是________mL。
(2)实验①-⑥可以通过测定__________来比较过氧化氢的分解速率。
A 相同时间内产生氧气的体积
B 产生相同体积的氧气所需时间
C 相同时间内产生氧气的质量
(3)得出“过氧化氢溶液的浓度越大分解速率越快”结论所依据的实验是____(填序号)。
(4)通过实验①、②、④可得出的结论是_________。
(反思与评价)
(5)同学们认为实验室制氧气,应选择实验⑥而不选实验②的理由是________(答一点即可)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下列装置图填空:
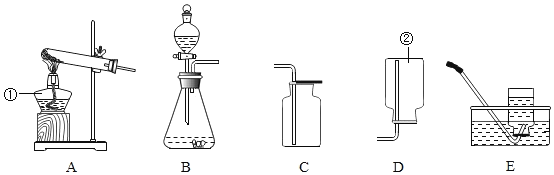
(1)写出上图中标有序号的仪器名称:①_________;②_________。
(2)实验室制取气体时,组装好仪器后,应先_________,再添加药品。
(3)实验室用石灰石和稀盐酸制取二氧化碳时,应选用的发生装置是______(选填装置序号),该反应的化学方程式为_______。
(4)简述用C装置收集二氧化碳时的验满方法:_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】人若长期食用“镉大米”(镉含量超标)会引起痛痛病(即骨癌病)。研究表明水稻对镉的吸收率与土壤的pH有紧密关系(如图所示),下列物质中可用于改良土壤结构,降低水稻对镉吸收率的是

A.氯化钾B.氢氧化钠C.熟石灰D.硫酸亚铁(水溶液显酸性)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请根据所学的知识完成下列相关问题。
(1)铁制品锈蚀的过程,实际上是铁与空气中的氧气、____________等发生了化学反应。
(2)餐桌上的餐具有竹木筷子、塑料水杯、不锈钢勺子,其中由合金制造的是________________。
(3)一定量的生铁与足量的稀盐酸充分反应后会有黑色残渣产生,这些黑色残渣的主要成分是________(写化学式)。
(4)实验室里常用酒精灯给物质加热,请写出酒精(C2H5OH)在空气中充分燃烧的化学方程式_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列关于燃烧现象的解释或分析正确的是( )
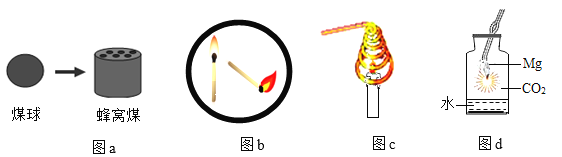
A. 图a中将煤球变成蜂窝煤后再燃烧,其目的是延长煤燃烧的时间
B. 图b中火柴头斜向下时更容易燃烧,是因为降低了火柴梗的着火点
C. 图c中蜡烛火焰很快熄灭,是因为金属丝阻碍空气的流动
D. 由图d中的现象可知,金属镁燃烧的火灾不能用二氧化碳灭火
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有些食品袋里装有一小袋铁粉作保鲜剂,化学兴趣小组对一包使用过且已经生锈的保鲜剂进行探究。
(提出猜想)保鲜剂可能的组成:①只有 Fe2O3; ②Fe和 Fe2O3的混合物。
(实验探究 1)探究已使用过的保鲜剂的成份
(1)取保鲜剂样品少量于试管中,加入过量稀盐酸,小组同学根据观察到的现象一致认为猜想②成立,他们观察到的现象是______。
(实验探究 2)保鲜剂中 Fe2O3含量的探究
称取保鲜剂样品 1.0g 装入硬质玻璃管中,按图1所示的装置进行实验。开始时缓缓通入CO 气体,过一段时间后再加热使其充分反应,待反应完全后,继续通 CO 气体直至玻璃管冷却。
(2)先通入CO气体一段时间后再加热的目的是______。
(3)反应前后称量相关装置和物质的总质量,其数据如下表:
反应前 | 反应后 |
玻璃管和保鲜剂的总质量 | 玻璃管和固体物质的总质量为 |
①装置中发生反应的化学方程式为__________________。
②分析表中的数据后,得出保鲜剂与反应后固体质量差值0.21g是______![]() 填标号
填标号![]() 。
。
a保鲜剂中铁的质量
b保鲜剂中氧化铁的质量
c保鲜剂中氧化铁与通过反应生成的铁的质量差
反应完全后,继续通 CO 气体直至玻璃管冷却,目的是______(任意写一条)。
(4)(反思评价)图1中装置存在的不足之处是_________。
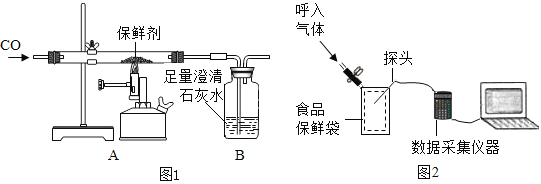
(附加题)(注意:正确回答下列问题加4分,总分不超过60分)
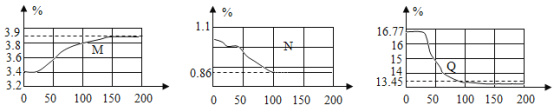
(实验探究)在如下图所示,保鲜袋中装有保鲜剂,将O2、CO2、湿度(测水蒸气)传感器探头放入保鲜袋中(有少量空气),然后快速向袋内呼出气体直到吹满,再打开仪器开始采集数据。采集的数据如下图所示,纵坐标均为某气体体积分数(%),横坐标均为时间(s)。据图回答下列问题:
(1)表示O2体积分数变化的曲线是______(选填“M”、“N”、“Q”),指出曲线N在0~50s内下降的原因______。
(2)查阅文献得知其他人员使用铁的缓慢氧化原理来测量封闭容器内的氧气含量时,可以将氧气消耗至大约1%,但此处氧气剩余含量明显偏高,试解释原因______(写出一条即可)。
(3)实验中,没有生成二氧化碳,但它的含量仍然发生了变化,请根据图像作出解释______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验是进行科学探究的重要途径。下列实验方案不能达到目的的是
A | B | C | D |
|
|
|
|
探究分子运动 | 测定空气中氧气含量 | 探究水的组成 | 验证质量守恒定律 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com