
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
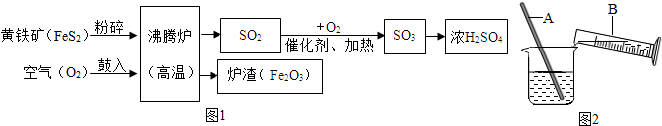
 为测定“碱”样品(主要成分为含少量NaCl的Na2CO3)中Na2CO3的含量,某化学课外活动小组的同学进行了以下探究:
为测定“碱”样品(主要成分为含少量NaCl的Na2CO3)中Na2CO3的含量,某化学课外活动小组的同学进行了以下探究:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
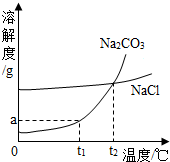
| A. | 若要将组成在N点的A溶液转变为M点的A溶液,可以采取恒温蒸发溶剂的方法 | |
| B. | t2℃时,A、C两种物质溶液的溶质的质量分数一定相等 | |
| C. | t2℃时,A、B两种物质的饱和溶液降温到t1℃,析出A的质量更大 | |
| D. | t3℃时,三种物质的溶质质量分数大小顺序为A>B>C |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 少量锌粒与适量稀硫酸混合,产生氢气 | |
| B. | 往澄清石灰水中加入酚酞溶液,石灰水变浑浊 | |
| C. | 把氢氧化钠固体放入适量的水中,产生大量的热 | |
| D. | 把用石蕊溶液染成紫色的干燥纸花放入二氧化碳气体中,纸花变成红色 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
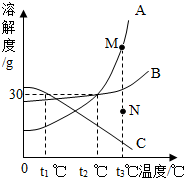
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
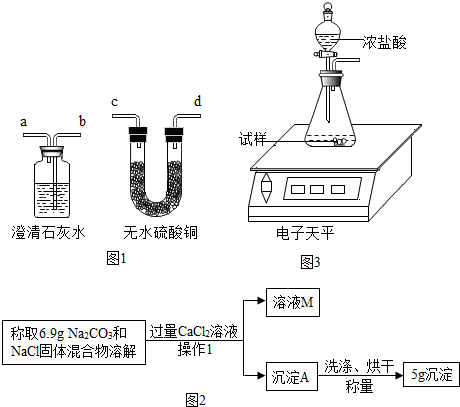
| 实验步骤 | 实验现象 | |
| 实验1 | 取安多夫样品少许加入试管中,加入醋酸,并把产生的气体通入澄清石灰水 | 产生气泡,澄清石灰水变浑浊 |
| 实验2 | 取安多夫样品少许加入试管中,加热使之充分反应,并把产生的气体通入澄清石灰水. | 试管口出现小水珠,澄清石灰水变浑浊,试管中残留白色固体粉末. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com