
【题目】在工、农业生产中,中和反应有着广泛的用途。为了证明氢氧化钠溶液与稀硫酸确实发生了化学反应,设计了如下实验方案。
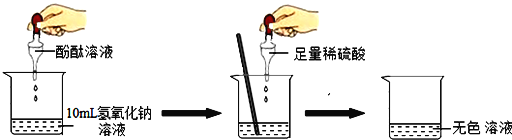
根据实验中颜色变化,可确定稀硫酸与氢氧化钠溶液发生了化学变化,反应的化学方程式为____。
现对反应后烧杯内无色溶液中溶质成分展开探究:
(提出问题)该烧杯内无色溶液中的溶质是什么?
(猜想)猜想一:Na2SO4;
猜想二:______;
(实验探究)
分别选取氯化钡溶液、紫色石蕊试液设计实验方案,请你判断并
实验方案 | 实验步骤 | 实验现象 | 实验结论 |
方案一 | 取样,滴入适量的氯化钡溶液 | 出现白色沉淀 | 猜想二成立 |
方案二 | 取样,滴入几滴紫色石蕊试液 | 溶液变红 | 猜想二成立 |
上述设计的实验方案中,正确的是____(填“方案一”或“方案二”),另外一个实验方案错误的原因是___。
(反思与拓展)
(1)根据上述探究结果,在分析化学反应后所得物质成分时,除考虑生成物外还需考虑_______。
(2)根据所学化学知识,验证烧杯内溶液中的溶质含有H2SO4,除以上方案外,下列哪些物质单独使用也能完成该实验?__________(填序号)
a pH试纸 b 生锈的铁钉 c 铜 d 氢氧化钡溶液 e 碳酸钠
【答案】2NaOH+H2SO4=Na2SO4+2H2O Na2SO4、H2SO4 方案二 因为NaOH和H2SO4反应后生成的硫酸钠也能和BaCl2反应产生白色沉淀BaSO4,而石蕊试液遇酸变红色 反应物是否过量 abe
【解析】
解:酚酞遇碱变红色,所以氢氧化钠溶液使酚酞试液变红;氢氧化钠与稀硫酸反应生成硫酸钠和水,化学方程式为:2NaOH+H2SO4=Na2SO4+2H2O;
[猜想]该烧杯内的溶液为无色,所以猜想一:Na2SO4;猜想二:Na2SO4、H2SO4;
[实验探究]因为NaOH和H2SO4反应后生成的硫酸钠也能和BaCl2反应产生白色沉淀BaSO4,而石蕊试液遇酸变红色,所以方案二正确;
[反思与拓展](1) 在分析化学反应后所得物质成分时,除考虑生成物外还需考虑反应物是否过量;
(2) a.利用pH试纸测定溶液酸碱度时,pH小于7,说明溶液中含有H2SO4;
b.铜不能和H2SO4反应;
c.铁锈的氧化铁和H2SO4反应生成硫酸铁和水,如果铁锈溶解,说明溶液中含有H2SO4;
d.氢氧化钡溶液和H2SO4、Na2SO4反应都能够产生白色沉淀;
e.碳酸钠和H2SO4反应产生气泡。


科目:初中化学 来源: 题型:
【题目】过氧化氢俗称双氧水,常温下是一种无色液体,性质比较稳定。在加热的条件下,它能分解生成氧气和水。查阅资料:
①将新制的浓度5%的双氧水加热到65℃时就有氧气产生,加热到80℃时就有较多氧气产生。
②若在相同质量5%的双氧水中加入少量二氧化锰固体,常温下就会立即产生氧气,反应速度快,所需时间短。
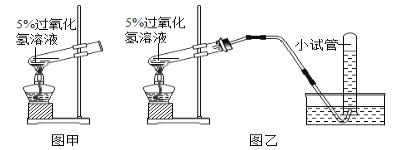
请根据上图回答问题:
(1)请你写出用双氧水和二氧化锰混合物制取氧气的反应文字表达式:____________
(2)小红按图甲装置进行实验,当试管中有大量气泡出现时,伸入带火星的木条,木条并未复燃,为此,他利用图乙装置收集气体,再用带火星的木条检验,木条复燃,那么图甲实验中带火星木条未复燃的原因是__________________。
(3)以下是某小组同学探究影响过氧化氢分解速率部分因素的相关实验数据。
实验序号 | H2O2溶液 浓度% | H2O2溶液体积/mL | 温度/℃ | MnO2的用量/g | 收集氧气的体积/mL | 反应所需 的时间/s |
① | 5 | 5 | 20 | 0.1 | 4 | 16.75 |
② | 15 | V | 20 | 0.1 | 4 | 6.04 |
③ | 30 | 5 | 35 | 0 | 2 | 49.21 |
④ | 30 | 5 | 55 | 0 | 2 | 10.76 |
①V=________:从实验_________和__________(填序号)对比可知,过氧化氢分解速率与过氧化氢溶液浓度有关。从表中实验数据对比可知,过氧化氢分解速率与温度的关系是:___
②用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总质量__(填“减小”“不变”或“增大”)。
(注意:若正确回答下列问题加4分,总分不超过60分)
③除了上述影响因素外,过氧化氢分解生成氧气的速率还与哪些因素有关?请你继续探究。(写出一种假设,并设计实验方案)
(你的假设)___________
(设计方案)
实验方法及步骤 | 可能观察到的实验现象 | 实验结论 |
_________ | _________ | 假设正确 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是用于电解水的简易实验装置:
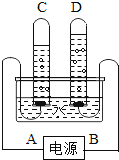
(1)该实验在水中加入少量氢氧化钠,目的是:_____;
(2)D试管收集到的气体应用_____检验,现象是:_____,B端为电源的_____极。且正极气体体积与负极气体体积比大约是:_____。
(3)写出该实验的化学方程式:_____;
(4)由此实验得到的结论是:_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】建立宏观与微观之间的联系,是化学学科特有的思维方式。请回答相关问题:
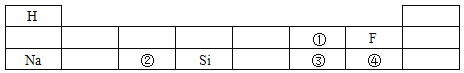
如上图所示是元素周期表的一部分,图 表示图中______处元素的原子结构示意图
表示图中______处元素的原子结构示意图![]() 填序号
填序号![]() ,在化学反应中该原子易______ 电子
,在化学反应中该原子易______ 电子![]() 填“得到”或“失去”
填“得到”或“失去”![]() ,显______价。图①、②、④三处元素中,与③处元素属于同一周期的是______(填序号)。
,显______价。图①、②、④三处元素中,与③处元素属于同一周期的是______(填序号)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请根据下列实验装置回答问题.
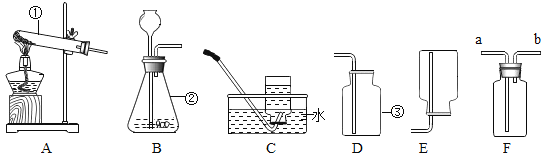
(1)写出标有编号仪器的名称①_____,②_____,③_____;
(2)实验室用高锰酸钾制氧气时,应选用的发生装置是_____,试管口应_____反应的文字表达式为_____。该实验要在试管口放一团棉花的作用是_____。用C装置收集氧气时,开始收集的最佳时刻是_____。用D装置收集氧气时,验满的方法是_____。
(3)若采用B装置制取氧气时,该反应的文字表达式为_____,与高锰酸钾制取氧气相比该方法的优点是_____。
(4)若将B装置中的长颈漏斗换成注射器,则其优点是_____。
(5)实验室用块状硫化亚铁(FeS)与稀硫酸反应制取硫化氢气体(H2S),文字表达式为:硫化亚铁+稀硫酸→硫酸亚铁+硫化氢。硫化氢气体的密度比空气大,能溶于水形成氢硫酸。根据以上知识推断:实验室制取硫化氢气体应选用的发生装置是_____,收集装置是_____;若用F装置收集硫化氢气体,则气体应从_____端(填“a”或“b”)通入。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】能源既是国家经济发展的命脉。也是国家发展战略的重要支柱。我省多地有效调整能源结构,稳步发展安全高效的能源体系,合理利用如下三种发电方式,并取得了显著成效。

(1)与C相比,A、B发电的共同优点是_________________________(写一条)。
(2)A的能量转化方式是把______能经过一系列变化转化成电能。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列四幅漫画描述了生活和自然中的现象,其中一幅漫画所描述的物质变化类型与其他三幅不同,这幅漫画是( )




A.饮料瓶变痷 B.云的形成 C.燃放烟花 D.酒精蒸发
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】科学家提出一种最理想的获得氢能源的循环体系(如图),下列说法正确的是
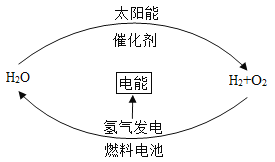
A.燃料电池能够使化学反应产生的能量转化为电能
B.该氢能源的循环体系实现后我们不必再节约能源
C.在此循环中发生了反应:![]()
D.氢能源要被广泛使用,急需解决的问题是寻找合适的光照条件下分解水的催化剂
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】研究性学习小组同学选择“过氧化氢(![]() )溶液分解生成氧气的快慢与什么因素有关”的课题进行探究。以下是他们探究的主要过程:
)溶液分解生成氧气的快慢与什么因素有关”的课题进行探究。以下是他们探究的主要过程:
(提出假设)过氧化氢溶液生成氧气的快慢与催化剂有关;
(实验方案)常温下,在两瓶相同体积的过氧化氢(![]() )溶液中分别加入相同质量的二氧化锰(
)溶液中分别加入相同质量的二氧化锰(![]() )和红砖粉,测量各生成一瓶(相同体积)氧气所需的时间:
)和红砖粉,测量各生成一瓶(相同体积)氧气所需的时间:
(实验记录)
实验编号 | 1 | 2 |
反应物 | 5%的过氧化氢( | 5%的过氧化氢( |
催化剂 |
|
|
时间 | 165秒 | 46秒 |
(结论)该探究过程得出的结论:在相同条件下,过氧化氢生成氧气的快慢与_____有关;
(反思)过氧化氢(![]() )溶液在常温下分解缓慢,加入二氧化锰(
)溶液在常温下分解缓慢,加入二氧化锰(![]() )或红砖粉后反应明显加快,若要证明二氧化锰(
)或红砖粉后反应明显加快,若要证明二氧化锰(![]() )和红砖粉是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的_____和_____是否改变;
)和红砖粉是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的_____和_____是否改变;
过氧化氢(![]() )溶液分解生成氧气的快慢还与哪些因素有关?请你帮助他们继续探究。
)溶液分解生成氧气的快慢还与哪些因素有关?请你帮助他们继续探究。
(提出假设)_____。(写一种)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com