


科目:初中化学 来源: 题型:
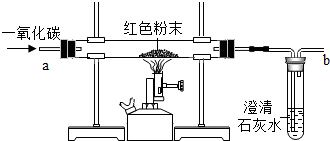 (一)在实验探究课上,老师给了同学们一包红色粉未,该粉末是铜粉和和氧化铁粉中的一种或两种.同学们为了确定该粉末的成分,进行如下探究.请你参与他们的探究并回答问题.
(一)在实验探究课上,老师给了同学们一包红色粉未,该粉末是铜粉和和氧化铁粉中的一种或两种.同学们为了确定该粉末的成分,进行如下探究.请你参与他们的探究并回答问题.| 实验中可能出现的现象 | 结论 |
| A | 假设1成立 |
| B | 假设2成立 |
| C | 假设3成立 |
| 实验步骤 | 实验现象 | 结论 |
| 可能的物质确实存在 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 空气 |
| 燃烧 |
| O2 |
| 高温催化剂 |
| H2O |
查看答案和解析>>
科目:初中化学 来源: 题型:
 如图是A、B、C三种物质的溶解度随温度变化的曲线图.根据图回答:
如图是A、B、C三种物质的溶解度随温度变化的曲线图.根据图回答:查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
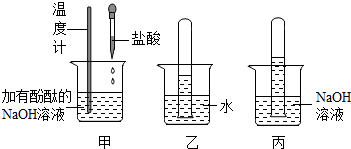 为探究碱的性质,进行如下实验.
为探究碱的性质,进行如下实验.查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com