
【题目】将50g硝酸钾放入盛有50g水的烧杯中充分溶解,如图是溶液质量随温度变化的曲线。
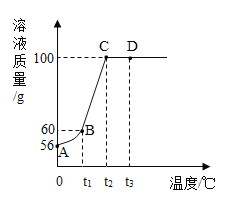
则t1°C时硝酸钾的溶解度为____g;在A、B、C、D4个点对应的溶液中___点的溶液一定是饱和溶液;向40gD点的溶液中加入10g水,所得溶液的溶质质量分数为____。
【答案】20g ABC(选对2个就可得1分) 40%
【解析】
将50g硝酸钾放入盛有50g水的烧杯中充分溶解,如图可知,t1℃时,溶液的质量为60g,即该温度下,50g水最多能溶解10g硝酸钾,故100g水最多能溶解20g硝酸钾,故t1℃时硝酸钾的溶解度为20g;
由图可知,将50g硝酸钾放入盛有50g水的烧杯中充分溶解,一开始,随着温度的升高,硝酸钾溶液的质量逐渐增加,说明一开始,溶质未全部溶解,随着温度的升高,溶解度增加,溶质不断溶解,到C点时,溶液质量不再变化,说明C点时,50g硝酸钾恰好溶解到50g水中,溶液恰好达到饱和,之后溶液质量不再变化,是不饱和溶液,故在A、B、C、D4个点对应的溶液中A、B、C点的溶液一定是饱和溶液;
由图可知,D点溶液的溶质质量分数为:![]() ,故40gD点溶液的溶质质量为:40g×50%=20g;故向40gD点的溶液中加入10g水,所得溶液的溶质质量分数为:
,故40gD点溶液的溶质质量为:40g×50%=20g;故向40gD点的溶液中加入10g水,所得溶液的溶质质量分数为:![]() 。
。


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:初中化学 来源: 题型:
【题目】多角度认识物质,能帮助我们更全面了解物质世界。请回答下列问题:
(1)认识物质的组成和结构从宏观角度分析,氧气是由氧_____组成(填“元素”“原子”或‘‘分子”,下同);从微观角度分析,氧气由氧____构成。
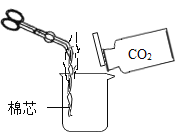
(2)认识物质的性质如图所示,将蘸有酒精的棉芯点燃后伸入烧杯中,向其中缓缓倾倒二氧化碳,观察到烧杯中的棉芯自下而上熄灭,说明二氧化碳具有的物理性质是____。
(3)认识物质的变化寒冷的冬天,“暖宝宝”因其能持久稳定发热受到人们的欢迎。“暖宝宝”中的发热原料是由铁粉、活性炭、氯化钠等物质组成。打开“暖宝宝”密封包装,原料与空气接触,“暖宝宝”就会开始发热。“暖宝宝”发热的过程实际上是铁与空气中的水、______发生化学反应的过程。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】分类和类比是学习化学重要的学习方法。
(1)请仔细观察下面三套装置,这三套装置在选用仪器、反应物、生成物等很多方面都有相同和不同,请你根据实验装置的某个不同点将其中的一个装置与其他装置区分出来:
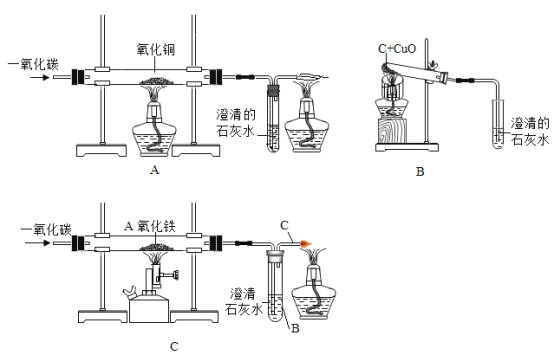
区分出的装置:________________;被区分的原因:___________________________;
(2)在有机物的大家族里有一类叫做“烷烃”,例如我们熟悉的甲烷、乙烷(C2H6)、丙烷(C3H8)、丁烷(C4H10)都是烷烃家族的一员,烷烃分子都是由碳原子和氢原子构成,且呈现一定的规律性,如用 a 表示碳原子个数,a 为自然数,且 a≥1,则烷烃的通式可表示为_____________________; 石蜡主要成分之一是一种碳原子个数为 22 的烷烃,则它的化学式为_______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】自然界并不缺少镁,缺少的是发现镁的眼睛。某化学兴趣小组开启寻镁之旅,现邀请你参与并完成相关内容。
(1)第一站:初识金属镁。
①金属镁的物理性质:__________(写一条);
②金属镁的化学性质:镁能与氧气反应,反应的化学方程式为___________。
(2)第二站:制备金属镁。小组同学模拟工业上从海水晒盐剩下的苦卤溶液中提取镁,流程如下:

流程中操作a为_________,步骤中Mg(OH)2与加入的X发生中和反应,请写出相关的化学方程式______。
(3)第三站:再探金属镁。
(提出问题)镁能否与热水反应 ? 如果反应,产物是什么?
(相关信息)①Mg+2H2O=Mg(OH)2+H2↑②氢氧化镁在热水中能部分溶解,液体呈碱性。
实验操作 | 实验现象 | 实验结论 |
①将打磨好的镁条放入盛有热水的试管中,收集气体并将气体点燃; | ①气体能被点燃,产生淡蓝色的火焰; | 镁能与热水反应,生成氢氧化镁和氢气 |
②反应后向试管中滴入酚酞试液 | ②________ |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】1898年德国人首次发现空气中的氮能被碳化钙固定而生成氰氨化钙(CaCN2),为合成氨工业奠定了基础,从而促进了氨碱工业的全面发展,工业上制取纯碱的部分流程如下:
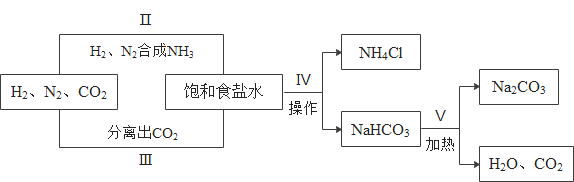
(1)氰氨化钙与水蒸气反应生成氨气和碳酸钙,该反应的化学方程式是____。
(2)碳酸氢钠只有在固态时,加热才会分解,则第IV步中操作的名称是___。
(3)实验室从混合气体H2、N2、CO2中分离出CO2的实验装置如图所示。广口瓶甲和分液漏斗中盛放的药品分别是______溶液(填化学式)、稀硫酸。
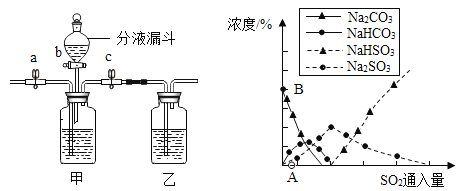
(4)纯碱用途广泛。工业上可用废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3,达到减少污染、节约资源的目的。反应过程中溶液组成变化如图所示。
①吸收初期(图中B点以前)反应的化学方程式为_______。
②不断通入SO2,最终产物是____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知A、B、C、D、E是中学化学常见的化合物,其中B、C都是氧化物,D是一种碱,其相对分子质量为74,A、B、D、E属于不同类别的化合物。图中“-”表示相连的物质间能发生反应,“→”表示物质间存在转化关系。

(1)若A属于盐,则E属于______,C在生活中的一种用途是______。
(2)若A属于酸,则E生成B反应的化学方程式为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列图像能正确反映对应变化关系的是
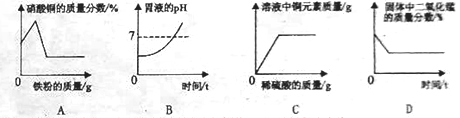
A. 在一定量的硝酸银和硝酸铜的混合溶液中加入铁粉至过量
B. 用胃舒平[主要成分Al(OH)3]治疗胃酸过多时胃液pH的情况
C. 向盛有一定量氧化铜粉末的烧杯中不断加入稀硫酸至过量
D. 加热一定量氯酸钾和二氧化锰固体混合物
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为了消除碘缺病,我国政府规定某地区居民的食用盐必须加碘。图为广东盐业总公司生产的加碘盐的部分标签,请根据标签图回答:

(1)食用盐必须加碘的“碘”是指___(填单质或元素或原子);该加碘盐属于___(填纯净物或混合物)
(2)碘酸钾(KIO3)中碘元素的化合价为___;
(3)从标签的“食用方法”推测,碘酸钾的一种化学性质是___.
(4)请根据化学式计算:
①碘酸钾的相对分子质量:___;(列式计算);
②碘酸钾中各元素间的质量比K:I:O=___;
③碘酸钾中碘元素的质量分数:___(列式计算,精确到0.1%);
(5)为确保碘盐中碘的最低含量,1Kg碘盐中至少应加入碘酸钾___mg(精确到0.1mg).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向一定质量的Na2SO4、MgSO4混合溶液中先后滴加150.0g 3.42%的稀Ba(OH)2溶液、100.0g稀H2SO4,产生沉淀的质量与滴加的溶液质量关系如图所示。下列说法不正确的是
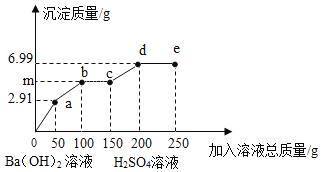
A.m=5.24
B.a点沉淀的成分为两种
C.所用稀H2SO4的质量分数为3.92%
D.向e点所得溶液中滴加紫色石蕊试液,溶液呈红色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com