
| FeCl2溶液 | FeCl3溶液 | |
| 加入Fe粉 | 无明显变化 | 溶液变成浅绿色 |
| 加KSCN溶液 | 无明显变化 | 溶液变成红色 |
| 实验操作 | 实验现象 | 结论与解释 |
| ①取少量的黑色固体于试管中,滴加适量的稀盐酸 ②向步骤①所得的溶液中,滴加KSCN溶液 | 甲组: 固体溶解,无气泡冒出 加KSCN溶液后,溶液变成红色 | 甲组用CO还原Fe2O3反应的化学方程式是CO+3Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe3O4+CO2 |
| 乙组: 固体溶解,有气泡冒出 加KSCN溶液后,溶液颜色无明显变化 | 黑色固体的成分是Fe |
分析 【实验过程】根据现象及结论并结合资料提供的信息进行分析;
【实验反思】(1)根据实验结论及资料提供的信息结合实验的注意事项、质量守恒定律等知识逐项分析;
(2)根据信息结合铁的化学性质对实验结论进行评价.
解答 解:【实验过程】甲组现象固体溶解,无气泡冒出,说明是验证产物遇到酸是否能够产生氢气,因此加入的试剂可以是稀盐酸,无气泡产生,说明黑色固体不是铁,则是四氧化三铁,因此反应的方程式为:CO+3Fe2O3 $\frac{\underline{\;高温\;}}{\;}$2Fe3O4+CO2;
乙组的结论是铁,因此和稀盐酸混合会产生气泡;
【实验反思】(1)a、根据甲乙的实验可以看出温度会影响反应的产物;
b、向步骤①所得的溶液中,滴加试剂A溶液变成红色,根据资料氯化铁溶液与试剂A混合溶液变成红色,因此试剂A用于检验FeCl3溶液,从而证明四氧化三铁的存在,故说法正确;
c、进行CO还原Fe2O3的实验时,因为有一氧化碳的剩余,因此一定要进行尾气处理,故说法正确;
d、因为氧化铁被一氧化碳还原,会失去部分氧或全部的氧,因此得到的黑色固体的质量一定小于参加反应的Fe2O3的质量,故说法正确;
(2)若固体是Fe和Fe3O4的混合物,根据信息过量的Fe可与FeCl3反应生成FeCl2,加入KSCN溶液同样能观察到溶液无明显变化,因此乙组的实验结论有欠缺.
故答案为:
【实验过程】
①稀盐酸; CO+3Fe2O3 $\frac{\underline{\;高温\;}}{\;}$2Fe3O4+CO2;有气泡冒出;
【实验反思】
(1)abcd
(2)认同,若固体是Fe和Fe3O4的混合物,过量的Fe可与FeCl3反应生成FeCl2,加入KSCN溶液同样能观察到溶液无明显变化.
点评 本题属于信息型的实验探究题的考查,难度较大,突破了常规化学知识的运用,解题的关键是充分利用题目给予的信息结合相关的已有知识进行解答.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:初中化学 来源: 题型:选择题
| A. | 原子不能再分 | |
| B. | 原子核是由质子和电子构成的 | |
| C. | 原子可以构成分子,也可以构成物质 | |
| D. | 相对原子质量就是原子实际质量和简称 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 商品名称 | 小苏打 | 食臭粉 | 混合碱性膨松剂 |
| 主要成分 | 碳酸氢钠 | 碳酸氢铵 | 碳酸氢钠和碳酸氢铵 |
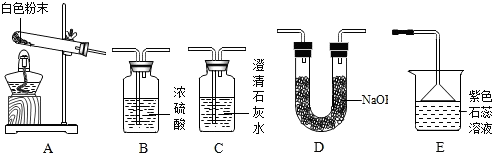
| 实验序号 | 实验装置 | 实验现象 | 实验结论及分析 |
| 实验1 | 选用A、B、C | C中澄清石灰水变浑浊 | 有CO2生成,C中反应的化学方程式是 CO2+Ca(OH)2═CaCO3↓+H2O |
| 实验2 | 选用A、 D和E | E中紫色石蕊溶液变成 蓝色 | 有NH3生成 |
| 实验序号 | 实验目的 | 实验装置 | 数据记录 | 实验结论 |
| 实验3 | 测定生成CO2的质量 | 选用A、B、D | 装置D增重a g | 该粉末为“混合碱性膨松剂” |
| 实验4 | 测定生成NH3的质量 | 选用A、B、D | 装置B增重1.7g |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
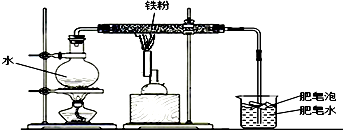 小明记得在学习金属活动性顺序的应用时,老师曾说过一般不会用K、Ca、Na等活泼金属和盐溶液进行置换反应,因为这些金属能直接和水发生反应生成对应的碱和氢气.小明查阅资料如下:
小明记得在学习金属活动性顺序的应用时,老师曾说过一般不会用K、Ca、Na等活泼金属和盐溶液进行置换反应,因为这些金属能直接和水发生反应生成对应的碱和氢气.小明查阅资料如下:| 实验方案 | 实验现象 | |
| 甲 | 将磁铁靠近黑色粉末 | 黑色粉末可被磁铁全部吸引 |
| 乙 | 取少量黑色粉末加入稀盐酸中 | 有气泡 |
| 实验方案 | 实验现象 | 结论或化学方程式 |
| 1、取实验后的黑色粉末,加入足量的A溶液,搅拌使反应充分. | 黑色物质表面有红色物质,溶液颜色出现较浅的绿色,烧杯底部仍有较多黑色物质 | Fe+CuSO4=FeSO4+Cu |
| 2、过滤、洗涤、干燥,再用磁铁吸引 | 黑色物质可被磁铁全部吸引,留下红色固体 | 被磁铁吸引的物质是铁 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. |  称16.5g氢氧化钠 | B. |  稀释浓硫酸 | ||
| C. |  滴管的使用 | D. | 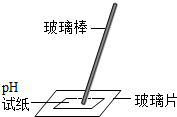 测溶液的pH值 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com