
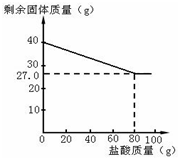
 某化学兴趣小组的同学为测定假黄金(铜锌合金)中各组成元素的质量分数,称取40克假黄金置于烧杯中,用某浓度的稀盐酸100克,分5次加入,每次充分反应后,取出固体,经过滤、干燥等操作后称重,各次稀盐酸用量和剩余固体质量记录如下:
某化学兴趣小组的同学为测定假黄金(铜锌合金)中各组成元素的质量分数,称取40克假黄金置于烧杯中,用某浓度的稀盐酸100克,分5次加入,每次充分反应后,取出固体,经过滤、干燥等操作后称重,各次稀盐酸用量和剩余固体质量记录如下:| 实验次数 | 稀盐酸的用量(g) | 剩余固体的质量(g) |
| 1 | 20 | 36.75 |
| 2 | 20 | 33.50 |
| 3 | 20 | 30.25 |
| 4 | 20 | 27.00 |
| 5 | 20 | 27.00 |
分析 (1)由曲线图可知,加入80g盐酸后恰好完全反应,剩余27.00g铜,根据铜的质量和假黄金的质量来计算合金与盐酸的质量比;
(2)剩余固体是铜,根据铜的质量和假黄金的质量可以计算出合金中锌的质量分数;
(3)由锌和完全反应时盐酸的质量根据锌与盐酸反应的化学方程式可以计算出稀盐酸中溶质的质量分数和生成氯化锌、氢气的质量.
解答 解:(1)由曲线图可知,加入80g盐酸后恰好完全反应,剩余27.00g铜,此时合金与稀盐酸的质量比=40:80=1:2,所以当所用合金与稀盐酸的质量比为1:2时,表明锌恰好完全溶解;
(2)锌和盐酸反应,而铜和盐酸不反应,加入过量盐酸后,剩余固体为铜,铜的质量为27.00g;锌的质量=40g-27.00g=13g,故合金中锌的质量分数为$\frac{13}{40}$×100%=32.5%
(3)设3.25g锌与质量为x的氯化氢恰好完全反应.
Zn+2HCl=ZnCl2+H2↑
65 73
3.25g x
$\frac{65}{73}=\frac{3.25g}{x}$,x=3.65g,故稀盐酸的质量分数=$\frac{3.65g}{20g}$×100%=18.25%
答:(1)从图可知,当所用合金与稀盐酸的质量比为1:2时,表明锌恰好完全溶解.
(2)合金中锌的质量分数为32.5%.
(3)稀盐酸中溶质的质量分数为18.25%
点评 本题主要考查学生利用化学方程式和溶质质量分数公式进行计算的能力,解题时要知道铜与稀盐酸不反应,铜锌合金与稀盐酸的反应,为锌与稀盐酸的反应,然后根据化学方程式进行计算,问题即可迎刃而解.


科目:初中化学 来源: 题型:选择题
| A. | 紫色石蕊试液 | B. | 二氧化碳气体 | C. | 碳酸钠溶液 | D. | 氯化钡溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
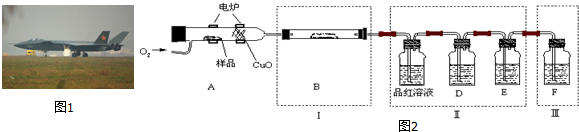
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 如图表示了x、y、z事物间的从属关系,下列选项中不符合图中事物间从属关系的是( )
如图表示了x、y、z事物间的从属关系,下列选项中不符合图中事物间从属关系的是( )| X | Y | Z | |
| A | 氧化物 | 化合物 | 纯净物 |
| B | 基因 | DNA | 染色体 |
| C | 中和反应 | 复分解反应 | 氧化还原反应 |
| D | 质子 | 原子核 | 原子 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
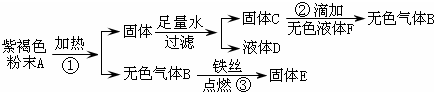
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com