
【题目】已知碳﹣12原子的质量为1.993×10﹣26kg,A原子的质量为5.146×10﹣26kg,若A原子核内中子数比质子数多1.求:
(1)A的相对原子质量=_____.
(2)A原子的核外电子数为_____.
(3)相对原子质量是原子的实际质量_____(判断对错);
相对原子质量是个比值它没有单位_____(判断对错);
原子的实际质量是有单位的,是克或者千克_____.(判断对错)
科目:初中化学 来源: 题型:
【题目】孔雀石主要成分为Cu2(OH)2CO3(难溶于水),还含有少量SiO2(难溶于水、不与稀硫酸反应)、Fe2O3等杂质。工业上以孔雀石为原料制取铜的部分工艺流程如下图。
查阅资料:Fe2(SO4)3+Fe=3FeSO4

仔细分析流程,请回答:
(1)固体b的化学式为________。
(2)溶液c中阳离子有________(写离子符号)。
(3)操作一、二、三均为________(填操作名称)。
(4)在气体a生成CaCO3的过程中,发生反应:CO2+CaCl2+2NH3+H2O=CaCO3↓+2X,X的化学式为______;Fe2O3与稀硫酸反应的化学方程式为________。
(5)若所得溶液C的质量为240t,测定出溶液C中硫酸铜的质量分数为10%,请计算固体d中铜的质量_______(写出计算过程)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学兴趣小组用如图装置进行实验,发现镁片完全溶解、石灰水浑浊。
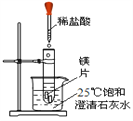
(一)石灰水变浑浊的原因是:
(1)镁和盐酸的反应________(填“吸热”或“放热”)。
(2)_____________________________________________。
(二)甲同学测得反应后试管内溶液pH<7 ,该溶液pH<7的可能原因是:
①MgCl2溶液的pH<7; ②__________________________。
(三)乙同学将反应后试管内溶液冷却,加入镁粉并滴入酚酞,溶液颜色无变化,再加热,发现溶液慢慢浑浊且变红。
【猜想】对实验中“溶液慢慢浑浊且变红”的原因,乙同学提出猜想:
MgCl2+2H2O=Mg(OH)2↓+2HCl,大家都认为此猜想不合理,理由是_________。
【查阅】资料1:Mg(OH)2难溶解于水,升高温度可加大其在水中的溶解度。
资料2:K、Ca、Na、Mg等活泼金属在一定条件下能与水反应,产生碱和气体。
【实验】乙同学重新在滴有酚酞的热水中加入镁粉,观察到液体慢慢变红并浑浊,镁粉表面产生气泡。收集并点燃气体,发现能燃烧。乙同学实验中“溶液慢慢浑浊且变红”的原因请用化学方程式表示:___________________。
(四)丙同学在做实验时,不小心将镁条掉入到碳酸氢钠溶液中,发现产生大量的气泡和白色不溶物。他非常好奇,进行了如下探究。
【提出问题】镁条与碳酸氢钠溶液反应,产生的气体和白色不溶物分别是什么?
【查阅资料】
Mg(OH)2 | MgCO3 | |
溶解性 | 难溶于水 | 微溶于水 |
热稳定性 | 受热易分解,能生成两种氧化物 | 受热易分解,能生成两种氧化物 |
实验探究一:镁条与碳酸氢钠溶液反应产生什么气体呢?
猜想 | 实验方法 | 现象 | 结论 | |
① | 二氧化碳 | 收集气体于集气瓶中,而后将气体通入澄清石灰水中; | 无明显现象 | 猜想①不成立 |
② | 氧气 | 收集气体于集气瓶中,而后将________放入瓶中; | 无明显现象 | 猜想②不成立 |
③ | 氢气 | 第一步,点燃产生的气体; 第二步,在火焰上罩内壁涂有石灰水的烧杯。 | 气体能被点燃; 烧杯内壁无现象; | 猜想______成立 (填序号) |
④ | _____ | |||
⑤ | 甲烷 | |||
实验探究二:
【提出问题】镁条与碳酸氢钠溶液反应,产生的白色不溶物是什么?
【作出猜想】丙同学根据资料分析认为白色不溶物可能是Mg(OH)2和MgCO3中的一种或两种。
【进行实验】
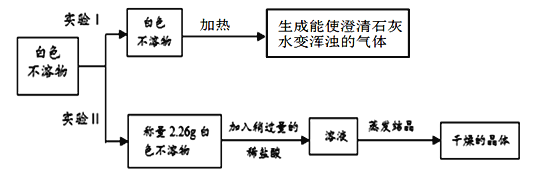
(1)根据实验Ⅰ的现象,写出加热白色不溶物时一定发生的化学反应的方程式__________;
(2)实验Ⅱ中 称量“干燥的晶体”质量为2.85g,由此通过计算确定白色不溶物是成分是_________________。(请你写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室中,利用下列装置可以制取某些气体,请回答下列问题。
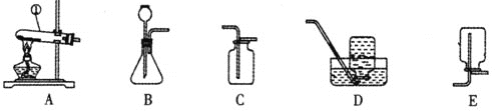
(1)写出图中标号①仪器的名称是_____。
(2)用过氧化氢溶液和MnO2混合制取O2,应选用的发生装置是(填序号,下同)_____,要收集较纯净的O2最好选用的收集装置是_____。
(3)加热固体碳酸氢钠或固体碳酸氢铵都能产生CO2,其反应的化学方程式分别是:
①![]() ②
②![]()
某同学采用反应①的方法制取CO2 , 应该选用的发生装置是____,他不选择反应②制取CO2的理由是____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示是A、B、C三种固体物质的溶解度曲线图。

(1)甲图中,t2℃时A、B、C三种物质中溶解度最大的是__________。P点所表示的含义是___________。
(2)t2℃时,将等质量的A、B、C三种物质溶解形成饱和溶液,所得溶液质量最大的是__________(填“A”或“B”或“C”)
(3)如乙图所示,20℃时,把试管放入盛有X的饱和溶液的烧杯中,在试管中加入几小段镁条,再加入5mL稀盐酸,立即产生大量的气泡,同时烧杯中出现浑浊,则X可能为A、B、C三种固体物质中的哪一种__________?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某校化学兴趣小组学习了气体的制取和收集后,对相关知识进行总结,请你一起参与,并完成下面题目内容:
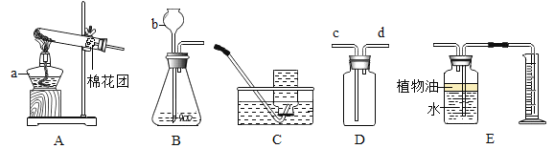
(1)写出b仪器名称:_____。
(2)若用D装置收集氧气,则氧气应从_____口通入(填“c”或“d“)
(3)装置B可用于制取CO2,实验室制取二氧化碳的化学方程式为_____;
(4)若用装置E收集CO2并测量生成的CO2气体的体积,其中在水面上放一层植物油的目的是:_____。
(5)若用A装置制氧气,实验室制氧气的化学方程式为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙试管中各盛有10.0g水,向其中一支试管中加入 3.0g Na2CO3粉末,另一支试管中加入3.0g NaCl粉末,按图1,2进行实验,下列说法正确的是( )
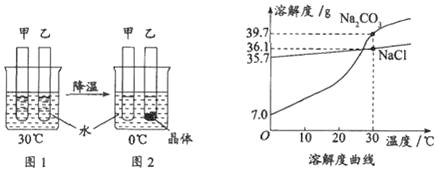
A. 甲试管中加入的粉末是Na2CO3
B. 0℃时,甲试管中的溶液一定不饱和,乙试管中的溶液一定饱和
C. NaCl中含有少量Na2CO3,可用冷却热饱和溶液的方法提纯NaCl
D. 30℃时,若使图1中甲、乙试管内的溶液恰好变为相应饱和溶液,甲试管中加入对应溶质的质量大于乙试管中加入对应溶质的质量
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】阅读下面科普短文(原文作者:许谦,有删改)
酸奶口感酸甜,营养丰富,是深受人们喜爱的一种乳制品。与普通牛奶比较,酸奶中的蛋白质和钙更易被人体消化吸收,是乳糖不耐症患者的良好食品。
通常的酸奶是将牛奶发酵而制成的。牛奶中主要含有蛋白质、乳糖和脂肪。在发酵过程中,乳酸菌把乳糖(C12H22O11)转化成乳酸(C3H6O3),使得牛奶的酸度升高。随着酸度增加,蛋白质分子互相连接,形成了一个巨大的“网络”,这个“蛋白质网络”把乳糖、水、脂肪颗粒都“网”在其中。所以,奶变“粘”、变“酸”了。

酸奶中含有大量活力较强的乳酸菌。乳酸菌可抑制某些腐败菌和病原菌的繁殖,从而维持人体内,尤其是肠道内正常的微生态平衡,促进食物的消化吸收。酸奶在储藏和配送过程中,乳酸菌的数量会因乳酸的过量积聚而明显减少,而酸奶的乳酸积聚又会影响到酸奶的酸度。有研究者选取某种市面常见的酸奶进行实验,数据如下表所示。
表某品牌酸奶酸度的变化
温度/℃ 时间/天酸度/°T | 4 | 28 | 37 |
0 | 67.7 | 67.7 | 67.7 |
2 | 73.9 | 77.1 | 79.2 |
4 | 76.4 | 82.7 | 86.3 |
6 | 85.5 | 92.2 | 98.9 |
8 | 90.2 | 98.7 | 113.2 |
1999年颁布的国标GB2746-1999中,对成品酸奶的酸度规定为“酸度不小于70°T”。按照一般人的接受程度,酸奶酸度不能超过100°T。
依据文章内容回答下列问题。
(1)乳酸是由乳糖转化生成的,请比较二者的化学式,分析它们的相同点和不同点。
相同点:_____。
不同点:_____。
(2)实验中所用酸奶若在37℃条件下储存,_____天后,酸度一定会超出一般人的接受程度。(填字母序号,下同)
A 2 B 4 C 5 D 8
(3)由表中实验数据可知,影响酸奶酸度的因素有_____。
(4)下列关于酸奶的说法正确的是_____。
A 酸奶适用于乳糖不耐症患者食用
B 酸奶放置时间越长,乳酸菌含量越高
C 酸奶中的乳酸菌对人类身体有害无益
D 酸奶变“粘”与蛋白质分子相互连接形成巨大“网络”有关
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】铜及其化合物在生产、生活中都有广泛的应用。
一、铜的冶炼
资料一:考古工作者从安阳的商代铸铜遗址中,发现当时冶炼铜的主要矿物原料是孔雀石[主要成分是碱石碳酸铜Cu2(OH)2CO3],主要燃料是木炭,冶炼温度估计在1000℃左右。
资料二:西汉刘安著《淮南万毕术》中记载“曾青得铁则化为铜”。“曾青”可能是硫酸铜一类的物质,将孔雀石溶于硫酸中得此溶液,当把铁粉投入此溶液中即可得铜。
(1)关于“曾青”和孔雀石的说法中,正确的是___。
A 前者属于盐,后者的主要成分是碱 B 前者属于酸,后者的主要成分是碱
C 前者和后者的主要成分都属于氧化物 D 前者和后者的主要成分都属于盐
(2)以孔雀石为原料的冶炼过程中,用现代化学的观念审视,可能涉及的化学反应有__。
①Cu2(OH)2CO3![]() 2CuO+CO2↑+H2O ②2CuO+C
2CuO+CO2↑+H2O ②2CuO+C![]() 2Cu+CO2↑
2Cu+CO2↑
③CuO+CO![]() Cu+CO2 ④CO2+C
Cu+CO2 ④CO2+C![]() 2CO
2CO
A ①② B ①③ C ①②③ D ①②③④
(3)已知有元素化合价升高和降低的反应属于氧化还原反应。在(2)的四个反应中,不属于四种基本反应类型的有(填序号,下同)____,不属于氧化还原反应的有____。
(4)资料二中,假设溶解孔雀石的酸是稀硫酸,写出用此方法冶炼铜的化学方程式:___,___。
二、铜及其化合物的应用
(5)碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等。碱式碳酸铜由Na2CO310H2O与CuSO45H2O反应制备,原理:2CuSO4+2Na2CO3+H2O=Cu2(OH)2CO3↓+2Na2SO4+CO2↑。称取14.0gCuSO45H2O、16.0gNa2CO310H2O,用研钵分别研细后再混合研磨,立即发生反应,有“嗞嗞”声,而且混合物很快成为“黏胶状”。将混合物迅速投入200mL沸水中,快速搅拌并撤离热源,有蓝绿色沉淀生成,过滤,用水洗涤,至滤液中不含SO42﹣为止,取出沉淀,风干,得到蓝绿色晶体。
①混合物发生反应时有“嗞嗞”声的原因是___。
②撤离热源的目的是___。
组成测定:
有同学查阅资料发现用Cu(OH)2CuCO3表示碱式碳酸铜是不准确的,较为准确、科学的表达式是mCu(OH)2nCuCO3,不同来源的碱式碳酸铜的m、n值需要具体测定。热分解法测定碱式碳酸铜组成的实验装置如下图所示,通过测定碱式碳酸铜在灼热后所产生的气体体积,推导出碱式碳酸铜中碳酸铜和氢氧化铜的含量,即可求出m和n的比值。
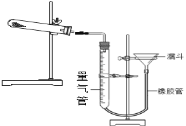
③三次平行实验测定结果如下表,则该样品中m:n=___,若量气管中所盛液体是水,则该测定值比理论值___(填“偏大”、“偏小”或“不变”)。(已知该状况下,二氧化碳密度为1.964g/L)
实验序号 | 样品质量/g | CO2体积/mL (已折算成标准状况下) |
1 | 0.542 | 44.82 |
2 | 0.542 | 44.80 |
3 | 0.542 | 44.78 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com