
����Ŀ���ס����Թ��и�ʢ��10.0gˮ��������һ֧�Թ��м���3.0g Na2CO3��ĩ����һ֧�Թ��м���3.0gNaCl��ĩ����ͼ1��2����ʵ�顣����˵����ȷ����
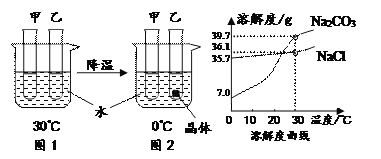
A. ���м���ķ�ĩ��Na2CO3
B. 0��ʱ��������Һһ�������ͣ�������Һһ������
C. Na2CO3�к�������NaCl��������ȴ�ȱ�����Һ�ķ����ᴿNa2CO3
D. 30��ʱ����ʹͼ1�мס����Թ��ڵ���Һǡ�ñ�Ϊ��Ӧ������Һ�����м����Ӧ�����������������м����Ӧ����������
���𰸡�BC
��������
A��0��ʱ���Ȼ��Ƶ��ܽ�ȴ���̼���Ƶ��ܽ�ȣ�����0��ʱ�о�����������̼���ƣ�û�о������������Ȼ��ƣ����Լ����Ȼ��ƣ�����̼���ƣ�����B��0��ʱ���Ȼ��Ƶ��ܽ����35.7g����10gˮ����Ҫ�ܽ�3.57g���ܴﵽ���ͣ����Լ���Һ�Dz�������Һ�������о���������������һ���DZ�����Һ����ȷ��C��̼���Ƶ���Һ�����¶ȵ�Ӱ��仯���Ȼ��Ƶ��ܽ�����¶ȵ�Ӱ��仯��������Na2CO3�к�������NaCl��������ȴ�ȱ�����Һ�ķ����ᴿNa2CO3����ȷ��D��30��ʱ��̼���Ƶ��ܽ�ȴ����Ȼ��Ƶ��ܽ�ȣ���ʹͼ1�мס����Թ��ڵ���Һǡ�ñ�Ϊ��Ӧ������Һ�����м����Ӧ����������С�����м����Ӧ����������������ѡBC��


 ��ʦ����ɳ���ʱͬ��ѧ����ϵ�д�
��ʦ����ɳ���ʱͬ��ѧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����C��H��O��N��Al��Fe����Ԫ����ѡ���ʺϵ�Ԫ�أ���Ҫ���û�ѧ������գ�
��1������笠����ӣ�_____��
��2����Է���������С�������_____��
��3��дһ�����Ϸ�Ӧ�Ļ�ѧ����ʽ��_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ��Ƽҵ������°������������Ƽ������ģ��������ͼ��ʾ��
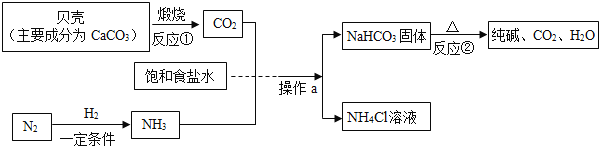
��1����Ӧ�ڵĻ�ѧ����ʽ��_____��
��2����ҵ���÷���Һ̬�����ķ�����ȡ����������_____�仯������������������ѧ������
��3������a��������_____��ʵ���ҽ��д˲�������IJ����������ձ�����������_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������ϡ���ᡢ����������Һ��̼������Һ�������ʡ�������ͼ��ʾ�����Ӧ��ת����ϵ��ͼ�С���������ʾ���˵����ʼ���Է�����ѧ��Ӧ����������ʾ�����ʴ�����Ӧ��ת����ϵ�������жϺ������ǣ�������
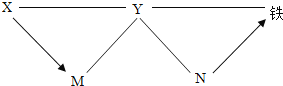
A. Xһ����̼������Һ
B. Yһ����ϡ����
C. Nת��Ϊ���ķ�Ӧ�������û���Ӧ
D. X��Y��M����֮�䶼���Է������ֽⷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʳ������������ı���Ʒ����ȡʳ�ε�;���ж��֡�
��1���������Ρ������β㺬�Ȼ��ơ������Ƶ����ʣ����������Ƶ���������_____ ������ţ��� ��ȥ�Ȼ�����Һ�е�������Ӧѡ�õ��Լ���_____���ѧʽ����Һ��
��2�����ƾ��Ρ��þ��в�������Ȼ����Ϊȼ�ϰ��ƾ��Ρ�CH4ȼ�յĻ�ѧ����ʽ��_____��
��3����ˮɹ�Ρ�ij�غ�ˮ����Ҫ���ʵĺ��������� �ú�ˮ���Ȼ��Ƶ���������Ϊ_____������ij�Ȼ�����Һ�� 85mL ˮ��Ӧѡ����Ͳ�Ĺ��Ϊ_____mL��
���� | ÿ 100g ��ˮ����������g�� |
ˮ | 96.5 |
�Ȼ��� | 2.7 |
������ | 0.2 |
���� | ���� |
��4���ɻ�������������Ҳ�����Ȼ��ƣ�������ʯ�ҡ�����ȣ���������ʱ������ԭ�ϼ���ˮ�У���Ͼ��ȼ��ɡ�
�����ʷ���ĽǶȿ�����������_____������еġ������_____�������ʵ����ƣ� ���׳ƣ�ԭ���п������������������_____���ѧʽ��������ˮ������Ӧ�Ļ�ѧ����ʽΪ_____���÷�Ӧ����_____��������ų��������ա�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������̳���±���Ƶ������һ����������������У��ȤС������ʦ��ָ���£�����������չ����ϵ��̽����
���������ϣ������Σ���һ����̼��狀��������ƶ��ɵ�ҩƷ�������ź��д̼����ã�
������ԭ����̼��茶�������İ����������д̼����ã��������Ų���������
��̼���[��NH4��2CO3]���������ֽ⣬���� NH3��H2O��CO2��
�����Գ�̽����֤���������Ļ�ѧ����
��1����ͬѧ������NH4+����֤ʵ�飺ȡ�����������Թ��У���������������Һ���ȣ����Թܿڷ�һ��_____���۲쵽��Ԥ�ڵ�ʵ��������д������������Һ��̼��立�Ӧ�Ļ�ѧ����ʽ_____��
��2����ͬѧ������ CO32������֤ʵ�飺ȡ�����������Թ��У��ټ���ϡ���ᣬ�������ɵ�����ͨ��_____��Ԥ�ڵ�ʵ��������_____��ʵ���۲쵽��Ԥ�ڵ�����
��������̽���ⶨ����������̼��泥�NH4��2CO3����������
������ȡ��Ʒ 6.0 �ˣ���ͼ 1 װ�ý���ʵ�飬����Cװ���ڷ�Ӧǰ�����ӵ�������Ϊ����NH4+��������
��3��װ��B������_____��װ��C����ͨ©����������_____��ͼ2װ���в����������������õ���_____��
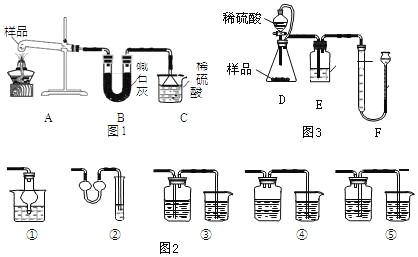
��4��С��ͬѧ�����ۺ���Ϊ�ø���װ�ò����ᵼ��̼��淋���������ƫС��ԭ����_____��
������ȡ��Ʒ6.0�ˣ���ͼ3װ�ý���ʵ�飬����Fװ�ò�����Ӧ��������������
��5����д��װ��D�з�����Ӧ�Ļ�ѧ����ʽ_____��װ�� D ���ܳ�ƽ��ѹǿ������Һ��˳�������⣬����_____�����á�
��6���÷���ʵ������������������������ȫ�����������У�_____��������Ҫ����������Ҫ����ͨ��N2���� �в��������������������У������������_____��
��7��ʵ�����������в�����������Ϊ 558mL���÷�������������̼��淋���������Ϊ_____��
����֪ʵ�������£�CO2���ܶ�ԼΪ 1.97g/L��������д�����̣���������ȷ�� 1%��
��8����������������ȷ���������ػᵼ������������̼��淋���������ƫ�����_____ ������ĸ��
a����Ӧǰ������Һ���� 0 �̶ȴ�����
b��ʵ�������������Һ����ƽ����
c����Ӧ������δ��װ����ȴ�����£��Ϳ�ʼ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϡ������������װ������������Һ���ձ��У����¶ȼƲ���ձ�����Һ���¶ȣ���Һ�¶������ϡ������������仯��ͼ��ʾ��
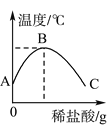
(1)��ͼ��֪��ϡ����������������Һ�����ķ�Ӧ��________(��������������������)��Ӧ��
(2)��A��B�����У��ձ�����Һ��pH��________��
(3)______��ʱǡ����ȫ��Ӧ��C�����Һ�к��е�����Ϊ________��
(4)��ͼ������������Һ��ϡ����ǡ����ȫ��Ӧ����ʾ��ͼ��
�ɴ˵ó��÷�Ӧ��ʵ����____��д����һ�����ϸ÷�Ӧʵ�ʵĻ�ѧ����ʽ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǻ�ѧ��ҵ�����Ϳ�����һ�ֳ�����Ԫ�أ�����6�ֺ���Ԫ�ص����ʣ�HCl��HClO��Cl2��NaClO��NaClO2��KClO3����ͨ���������Ͽ�֪��������(HClO)����Ư���ԣ��ܽ���ɫ���ʣ�����Һ����Ϊ��ɫ��
��1������6����������Ԫ�صĻ��ϼ�һ����_____�֡�
��2�������ʷ���ĽǶȿ���NaClO����____��˫��ѡ��NaClO������Ϊ____��
A ������ B ������ C �� D ��
��3������(Cl2)��ˮ��Ӧ�ɵõ���ҺA����ҺA�е�����Ϊ2���ᣬһ��Ϊ������(HClO)����һ��Ϊ���г�����һ���ᣬд����Ӧ�Ļ�ѧ����ʽ_____��
��4������ҺA�еμ���ɫʯ����Һ��Ԥ��ʵ�������Ϊ����Һ��_____�����Ϊ��ɫ��
��5��������»�ѧ����ʽ��2X+16HCl=2KCl+2MnCl2+5Cl2+8H2O����XΪ_____���ѧʽ�����˷�Ӧ�����ڳ�������ȡ����(Cl2)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
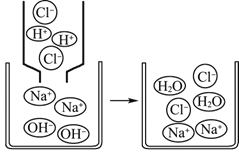
����Ŀ��ԭˮ��δ��������ˮ���к�����ɳ�������ϸ�������ʣ����ô�����ɱ��ϸ���������ܽ���ˮʱ������������ʹ����ᡣijˮ����������ˮ�ľ����������£�
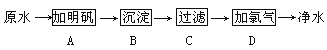
��1�����Գ�ȥ��������������ʵIJ�����________�����ţ���
��2��������ɱ���IJ���Ϊ______(����)��
��3��A���м�����������Ϊ____________��
��4���ó�����������ˮ��__________�������������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com