
【题目】用如图所示装置制取O2,并进行O2的性质实验。
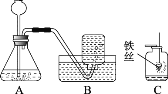
(1)A中反应的化学方程式为_______,选择B收集氧气的原因是______
(2)C中可观察到铁丝剧烈燃烧、________。
科目:初中化学 来源: 题型:
【题目】如图为A、B、C三种固体物质的溶解度曲线。
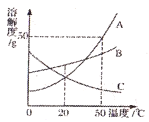
(1)20℃时,三种物质的溶解度大小关系为_____;
(2)50℃时,把50gA物质放入100g水中,充分搅拌,所得溶液是_____(填“饱和”或“不饱和”)溶液,该溶液中溶质质量分数为_____。
(3)20℃时,将接近饱和的B溶液变为饱和溶液,可采用_____方法。
(4)若将C的饱和溶液从50℃降温到20℃时,发生改变的是_____。
a溶剂质量 b溶质质量 c溶质质量分数 d溶解度
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】铁及其化合物在生产生活中应用广泛。
(一)铁的化合物制备
用废铁屑制备铁红( 主要成分为 Fe2O3)和 K2SO4 的部分流程如下图所示:
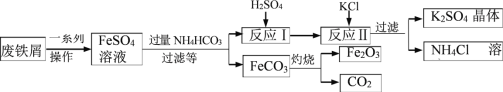
(1)加过量 NH4HCO3 反应时温度不宜过高的原因为 _____。
(2)反应Ⅰ生成的气体化学式是 _____;K2SO4 和 NH4Cl 在农业生产中都可做 _____。
(3)为检验 K2SO4 中是否混有 Cl-,要先加入足量 _____溶液,静置后再加向上层清液中滴加少量 _____溶液。
(4)在空气中灼烧 FeCO3 的化学方程式为 _____。
(二)铁的冶炼和探究
取 29.0g Fe2O3 粉末,小组同学用下图装置模拟炼铁,并测定反应后固体成分。
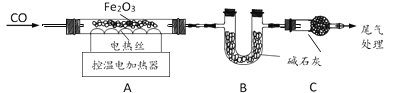
资料:碱石灰可吸收 H2O 和 CO2。
(1)连接装置,先______,再装入药品。
(2)实验时先通入 CO,目的是______。
(3)通过测定装置B 中固体质量变化情况,可求得A 中剩余固体质量,装置C 的作用是______。
(4)现直接测得装置A 中剩余固体质量为 21.0g,则装置 B 中固体应增重______g。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】复方氢氧化镁片[有效成分Mg(OH)2]和复方碳酸镁片[有效成分MgCO3]是两种常见的抗胃酸药。从A或B中任选一个作答,若均作答,按A计分。
A | B |
(1)Mg(OH)2的相对分子质量为___________。 (2)用复方碳酸镁片治疗胃酸过多症时,反应的化学方程式为_____________。 | (1)MgCO3中氧元素质量分数的计算式为___________。 (2)用复方氢氧化镁片治疗胃酸过多症时,反应的化学方程式为__________。 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】阅读下面科普短文。
表面地球有2/3以上都是海洋,海水为弱碱性,海洋表层水的pH约为8.2。海洋能够吸收大量空气中的二氧化碳,使地球大气层中的二氧化碳浓度降低,从而降低了地球的温室效应。
人类活动排放的二氧化碳有30%~40%会溶解于海洋等水体中。溶解的二氧化碳中的一部分会与水反应生成碳酸,导致海水的pH逐渐降低,这种现象被称为海洋酸化。
海洋酸化是对海洋生物多样性的一种威胁。在2.5亿多年前,地球经历了一次最引人注目的灭绝事件,大约90%的海洋生物和70%的陆地生物绝迹了。科学家认为,空气中二氧化碳含量的上升引起的海洋酸化,可能在古代生物灭绝事件中起到了至关重要的作用。尤其是长有坚硬外壳(主要成分是碳酸钙)的生物,如珊瑚和软体动物等,在海洋酸化的情况下,会出现外壳溶解现象而难易生存。
由于吸收了过多的二氧化碳,海洋正以前所未有的速度酸化。图中显示1990-2010年间某海域中二氧化碳浓度及海水pH的变化趋势。
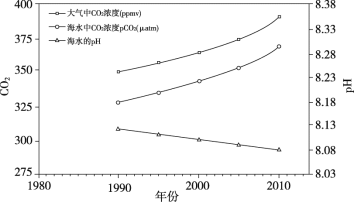
海洋酸化正在改变海洋生物赖以生存的化学环境,从而影响海洋生物的生存,导致整个海洋生物群落的发展不稳定,最终海洋将面临巨大的灾难。
依据文章内容,回答下列问题:
(1)海水中溶解的二氧化碳与水反应的化学方程式为________。
(2)珊瑚和软体动物难以在酸性条件下生存的主要原因是________。
(3)下列说法正确的是________(填字母序号)。
A 燃烧化石燃料会使空气中CO2含量上升
B 海洋吸收CO2,降低了地球的温室效应
C 海洋酸化可能在古代生物灭绝事件中起到至关重要的作用
(4)结合图中信息,解释海洋不断酸化的原因_________。
(5)写出一条解决海洋酸化问题的有效方法_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两种固体物质的溶解度曲线如图所示,下列结论正确的是( )
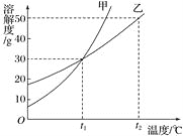
A. 乙的溶解度小于甲的溶解度
B. 甲的溶解度受温度影响比乙大
C. t2℃时,100 g乙的饱和溶液中含乙50 g
D. 相同质量的甲、乙的饱和溶液由t2℃降至t1℃,析出晶体较多的是乙
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在一支试管中放入一小段镁条(已擦去氧化膜),再向试管中加入一定量的盐酸,镁条表面有________产生,反应的化学方程式是________________________________________________________。
[发现问题]为了再次观察上述反应现象,小林同学用较长的镁条重做上述实验,但发现了异常现象,试管中出现了白色沉淀。
[实验验证1]小林同学针对两次实验的不同,设计对比实验方案,探究出现异常现象的原因。
试管(盛有同体积同浓度的盐酸) | ① | ② | ③ | ④ |
镁条长度 | 1cm | 2cm | 3cm | 4cm |
相同的实验现象(省略题干现象) | 快速反应,试管发热,镁条全部消失 | |||
沉淀量差异(恢复至20℃) | 无 | 少量 | 较多 | 很多 |
[得出结论]镁条与盐酸反应产生白色沉淀与________有关。
[追问]白色沉淀是什么物质?
[查阅资料]①20 ℃时,100 g水中最多能溶解氯化镁54.8 g;
②镁能与热水反应产生一种碱和氢气;
③氯化银既不溶于水也不溶于稀硝酸。
[做出猜想]猜想一:镁;猜想二:氯化镁;猜想三:氢氧化镁,猜想的依据是____________________(用化学方程式表示)。
[实验验证2]将白色沉淀洗涤干净,分别取少量沉淀于A、B、C试管中,进行如表实验:
试管 | 操作 | 现象 | 结论 |
A | 加入足量盐酸 | ________,白色沉淀________ | 猜想一不正确,但这种白色沉淀能溶于盐酸 |
B | 加入足量水 | 白色沉淀________ | 猜想二不正确 |
C | 加入适量稀硝酸 | 白色沉淀消失 | 原白色沉淀中含有的离子是: |
继续滴加几滴硝酸银溶液 | 出现大量白色沉淀 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请根据下列实验图回答问题。

(1)D试验中最易生锈的是______(填“a”“b”“c”)。
(2)C实验中观察到的现象是_______________________________________________ 。
(3)A实验中发生反应的化学方程式是____________________。
(4)对于B实验,小李同学进行了改进与创新,实验过程如下图所示:

上图改进实验与B实验相比,明显的优点是_________________(写一条即可)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】焙制糕点所用的发酵粉的主要成分之一是碳酸氢钠,某化学兴趣小组同学对碳酸氢钠的性质进行了以下探究,请回答:
(1)碳酸氢钠俗称___,是生活中一种常见的盐类物质
(2)探究碳酸氢钠溶液的酸碱性
(实验步骤)室温时,取少量碳酸氢钠固体加入试管中,加适量水溶解,用玻璃棒蘸取该溶液滴在pH试纸上,测得该溶液的pH=10。
(实验结论)碳酸氢钠溶液呈___(选填“酸性”碱性或“中性”)。
(3)探究碳酸氢钠固体与酸的反应
(实验步骤)取少量碳酸氢钠固体加入试管中,滴加稀盐酸,有____产生
(实验结论)碳酸氢钠与稀盐酸反应的化学方程式为____
(4)探究碳酸氢钠固体的热稳定性
(查阅资料)碳酸氢钠固体受热易分解,生成水、二氧化碳和一种常见的白色固体物质。
(实验步骤)实验装置如图,充分加热后,试管口有水珠出现,澄清石灰水变浑浊,试管中留下白色固体
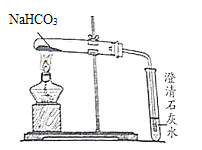
(提出猜想)该兴趣小组的同学认为充分加热后的固体产物可是NaOH或Na2CO3
①他们猜想的依据是___
②请设计实验,检验反应后的固体产物是NaOH或Na2CO3,并完成下表限选试剂及仪器:稀盐酸、氯化钙溶液、澄清石灰水、酚酞溶液、蒸馏水、试管、胶头滴管。
序号 | 实验操作 | 预期现象 | 结论 |
Ⅰ | 取少量加热后的固体产物放入试管A中,加入适量蒸馏水,充分振荡溶解,加入足量___,振荡,静止 | 产生白色沉淀 | 产物含Na2CO3 |
Ⅱ | 取Ⅰ操作后的上层清液于试管B中,滴加酚酞溶液 | ____ | 产物不含NaOH |
(实验结论)请写出碳酸氢钠受热发生反应的化学方程式:_____
(5)写出碳酸氢钠在生活中的一种用途______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com