
| 温度/℃ | 20 | 30 | 40 | 50 | 60 |
| 溶解度/g | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 |
分析 溶解度为一定温度下,100g水溶解溶质达到饱和状态时所溶解溶质的质量;结合A物质在不同温度下的溶解度,根据溶液变化流程中的条件,判断物质的溶解及所得溶液的状态或组成;由资料中物质A的溶解度可知,物质A的溶解度随温度升高而增大.
解答 解:(1)①中加入溶质37.2g,25℃A物质的溶解度要大于37.2g小于41.4g,所以该温度下①溶液为不饱和溶液,没有固体存在;结合图表中数据可知25℃A物质的溶解度要大于37.2g小于41.4g,所以②溶液一定是饱和溶液,该溶液应该是该温度下溶质质量分数最大的;③中溶进去的溶质质量为41.4g,③溶液的温度为60℃,该温度下A的溶解度是55.2g,所以③溶液为不饱和溶液,没有固体存在;④溶液中溶进去溶质质量为50.4g,④溶液的温度为60℃,该温度下A的溶解度是55.2g,所以④溶液为不饱和溶液;⑤中溶进去的溶质为50.4g,⑤溶液的温度是50℃,50℃A物质的溶解度为50.4g,所以溶液刚好饱和;
(2)④溶液的温度为60℃,该温度下A的溶解度是55.2g,所以④溶液为不饱和溶液,且此时溶进去的溶质质量最多,是50.4g,溶剂质量没变,所以溶质质量分数最大,⑤中溶进去的溶质为50.4g,⑤溶液的温度是50℃,50℃A物质的溶解度为50.4g,所以溶液刚好饱和,溶质质量分数与④的相同;
(3)④溶液的温度为60℃,该温度下A的溶解度是55.2g,所以④溶液为不饱和溶液,且此时溶进去的溶质质量最多,是50.4g,溶剂质量没变,所以溶质质量分数最大,⑤中溶进去的溶质为50.4g,⑤溶液的温度是50℃,50℃A物质的溶解度为50.4g,所以溶液刚好饱和,溶质质量分数与④的相同;
(4)①中加入溶质37.2g,25℃A物质的溶解度要大于37.2g小于41.4g,所以该温度下①溶液为不饱和溶液,没有固体存在;结合图表中数据可知25℃A物质的溶解度要大于37.2g小于41.4g,所以②溶液一定是饱和溶液,该溶液应该是该温度下溶质质量分数最大的;③中溶进去的溶质质量为41.4g,③溶液的温度为60℃,该温度下A的溶解度是55.2g,所以③溶液为不饱和溶液,没有固体存在;④溶液的温度为60℃,该温度下A的溶解度是55.2g,所以④溶液为不饱和溶液,没有固体存在;⑤中溶进去的溶质为50.4g,⑤溶液的温度是50℃,50℃A物质的溶解度为50.4g,所以溶液刚好饱和,也没有固体存在.
故答案为:(1)②⑤;(2)④⑤;(3)④⑤;(4)①、③、④、⑤.
点评 解答本题关键是要掌握三点:温度是多少,该温度下A物质溶解度是多少,该温度下到底溶进去的溶质质量是多少.


科目:初中化学 来源: 题型:解答题
| 溶液pH | 2 | 4 | 10 | 12 |
| 颜色 | 红 | 粉红 | 蓝 | 深蓝 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 碱性溶液的pH都大于7,所以碱溶液pH一定大于7 | |
| B. | 铝的金属活动性比铁强,则铝制品比铁制品更容易锈蚀 | |
| C. | 因为H2O和H2O2的组成元素相同,所以两者的化学性质相同 | |
| D. | 因为燃烧需要同时满足三个条件,所以灭火也要同时控制这三个条件 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
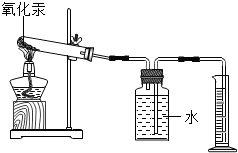 1673年,英国化学家波义耳曾经做了这样一个实验:在一个敞口的容器中加热金属汞(汞在加热的条件下能与氧气反应生成红色固体氧化汞),结果发现反应后的容器中物质的质量增加了.现某课题小组成员通过测定氧化汞分解前后反应物和生成物的质量是否相等来验证质量守恒定律.(已知:标准状况下氧气的密度为ρ,氧化汞分解的反应方程式:2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑)
1673年,英国化学家波义耳曾经做了这样一个实验:在一个敞口的容器中加热金属汞(汞在加热的条件下能与氧气反应生成红色固体氧化汞),结果发现反应后的容器中物质的质量增加了.现某课题小组成员通过测定氧化汞分解前后反应物和生成物的质量是否相等来验证质量守恒定律.(已知:标准状况下氧气的密度为ρ,氧化汞分解的反应方程式:2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑)查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
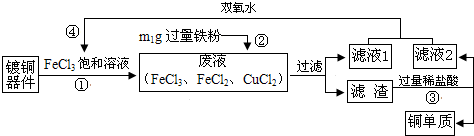
| A. | 步骤②中发生化合反应与置换反应 | |
| B. | “滤液1”中一定含FeCl2,一定不含CuCl2 | |
| C. | 步骤④反应为:2M+2FeCl2+H2O2=2FeCl3+2H2O,M是HCl | |
| D. | 由于部分Cu与FeCl3发生反应造成回收的铜单质比废液中的铜元素质量变少了 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 水、海水、蒸馏水 | B. | 冰、干冰、冰水混合物 | ||
| C. | 氧气、二氧化碳、空气 | D. | 氮气、氯酸钾、合金 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 物 质 | MgO | MgCl2 | Mg3N2 | Mg(NO3)2 | MgCO3 | Mg(OH)2 |
| 颜 色 | 白色 | 白色 | 淡黄色 | 白色 | 白色 | 白色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com