
| A. | 碱性溶液的pH都大于7,所以碱溶液pH一定大于7 | |
| B. | 铝的金属活动性比铁强,则铝制品比铁制品更容易锈蚀 | |
| C. | 因为H2O和H2O2的组成元素相同,所以两者的化学性质相同 | |
| D. | 因为燃烧需要同时满足三个条件,所以灭火也要同时控制这三个条件 |
分析 A、根据碱溶液显碱性,pH大于7进行分析;
B、根据铝的自我保护、铝的化学性质进行分析;
C、根据不同分子构成的物质化学性质不同进行分析;
D、根据灭火只需要控制这三个条件中的一个即可去分析.
解答 解:A、碱性溶液的pH都大于7,碱溶液显碱性,所以碱溶液pH一定大于7,故说法正确;
B、铝制品表面易形成一层致密的氧化物薄膜,阻止了铝的进一步锈蚀,而铁表面已形成疏松的氧化物薄膜,随着时间的进行,还会进一步锈蚀,故说法错误;
C、H2O和H2O2的组成元素相同,但两者的分子构成不同,两者的化学性质不相同,故说法错误;
D、灭火只需要控制这三个条件中的一个即可,故说法错误.
故选:A.
点评 本题较难,考查学生在熟悉所学知识的基础上进行知识的整合归纳,把握推理这一常用的学习方法,但应注意特例的存在.


 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 反应后生成CO2的质量为12.4g | |
| B. | 反应后CO2和H2O的质量比为11:9 | |
| C. | 原混合物中NaHCO3的质量为16.8g | |
| D. | 原混合物中Na2CO3的质量分数为16% |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 冬季市场上热销一种叫“暖宝宝”取暖贴.取暖贴的持续放热可以促进人体微循环,恢复正常的生理机能,从而消除疼痛,治疗疾病.对关节炎、肩周炎、腰腿痛等病痛都有很好的效果的.图是某“取暖片”外包装的图片.该“取暖片”中发热剂主要成分有铁粉、活性炭、氯化钠、水等,其发热是利用铁生锈时会放热.
冬季市场上热销一种叫“暖宝宝”取暖贴.取暖贴的持续放热可以促进人体微循环,恢复正常的生理机能,从而消除疼痛,治疗疾病.对关节炎、肩周炎、腰腿痛等病痛都有很好的效果的.图是某“取暖片”外包装的图片.该“取暖片”中发热剂主要成分有铁粉、活性炭、氯化钠、水等,其发热是利用铁生锈时会放热.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 编号 | 0.25%淀粉 溶液(ml) | 蒸馏水(ml) | 0.9%NaCl 溶液(ml) | 0.9%CuSO4溶液(ml) | 唾液溶液(ml) | 加入3滴 碘液后现象 |
| 1 | 3 | 2 | - | - | - | 变蓝色 |
| 2 | 3 | 1 | - | - | 1 | 不变蓝 |
| 3 | 3 | - | 1 | - | 1 | 不变蓝 |
| 4 | 3 | - | - | 1 | 1 | 变蓝色 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 温度/℃ | 20 | 30 | 40 | 50 | 60 |
| 溶解度/g | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 物质 | H2SO4 | Na2SO4 | MgSO4 |
| 溶解度/g | 与水任意比互溶 | 19.0 | 39.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 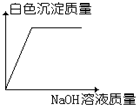 | B. |  | C. |  | D. | 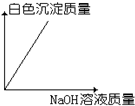 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com