
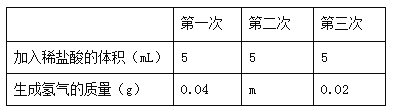
【题目】我国约在南北朝时就开始冶炼黄铜。黄铜是铜和锌的合金(Cu-Zn),它可用来制造电器零件及日用品。为了测定某黄铜样品中锌的质量分数(不考虑黄铜中的其他杂质),现将15mL稀盐酸分三次加入到5g黄铜样品粉末中,每次充分反应后,测定生成氢气的质量,实验数据见下表:
试求:
(1)m的值。
(2)实验过程中第多少次稀盐酸过量。
(3)此黄铜样品中锌的质量分数是多少?(写出计算过程)
【答案】(1)0.04 ;(2)三 ;(3)65%
【解析】从实验数据中可以发现:第一、二次每当加入5 mL稀盐酸时酸都完全反应,生成氢气的质量为0.04 g,即m=0.04,当第三次加入5 mL稀盐酸后,5 g黄铜中的锌已经完全反应,就只能生成0.02 g氢气了,则5 g黄铜中锌完全与稀盐酸反应生成氢气的质量为m(H2)=0.04 g+0.04 g+0.02 g=0.10 g,根据锌与盐酸反应的化学方程式,由氢气的质量可以求出锌的质量,从而求出锌的质量分数。答案:(1)0.04
(2)设此黄铜样品中锌的质量为x。
Zn+2HCl====ZnCl2+H2↑
65 2
x 0.10 g
65/x=2/0.10g x=3.25 g
则此黄铜样品中锌的质量分数为3.25 g÷5g×100%=65%。


科目:初中化学 来源: 题型:
【题目】请用化学符号表示或写出符号所表示的含义:
① 3个氢原子___________; ② 2O2____________; ③ 2个铝离子__________;
④ +4价锰的氧化物_______; ⑤ 碳酸钠______; ⑥ 氧化镁中镁元素化合价为+2_________;
⑦ 氯化钡中的阴离子_____ ; ⑧ 保持水分子化学性质的最小粒子____;
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】钢铁是重要的金属材料,在工农业生产和生活中应用非常广泛。
I.铁的应用
(1)下列铁制品的利用与金属导热性有关的是_________________
A.铁钳 B.铁锅 C.刀具
(2)“纳米α-Fe粉”可以用于食品保鲜,称之为“双吸剂”,因为它能吸收空气中的_______。
II.铁的冶炼
工业炼铁的原理是高温下用CO作还原剂,将铁从氧化物中还原出来。请回答下列问题:
(1)写出以赤铁矿为原料,在高温下炼铁的化学方程式:______________;
(2)高炉炼铁中,焦炭的作用除了可以生成一氧化碳外,还能____________。
Ⅲ.铁的活动性探究
现用一定量的AgNO3和Cu (NO3)2混合溶液,进行了如下图所示的实验,并对溶液A和固体B的成分进行了分析和研究.
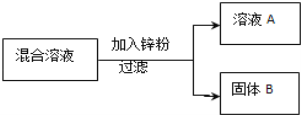
【提出问题】溶液A中的溶质可能有哪些?
【作出猜想】
①只有Zn(NO3)2
②有Zn(NO3)2、AgNO3
③有Zn(NO3)2、Cu(NO3)2
④有Zn(NO3)2、Cu(NO3)2、AgNO3
【交流讨论】不合理的猜想是_______(填标号),其理由是__________
【实验探究】根据如表中的实验步骤及现象,完成表中的实验结论
实验步骤 | 现象 | 实验结论 |
取少量固体B,滴加稀盐酸 | 有气泡产生 | 溶液A中的溶质成分符合猜想__, 固体B中的金属成分有________种. |
Ⅳ.生铁中铁含量的测定
某课外兴趣小组测定生铁(含杂质的铁,杂质既不溶于水也不溶于酸)中铁的质量分数,他们取五份样品,分别加稀硫酸反应.测得部分数据如下,请根据有关信息回答问题.
实验次数 | 1 | 2 | 3 | 4 | 5 |
取样品质量(g) | 30.0 | 30.0 | 30.0 | 30.0 | 30.0 |
取稀硫酸质量(g) | 50.0 | 100.0 | 150.0 | 200.0 | 250.0 |
产生气体质量(g) | 0.2 | a | 0.6 | 0.8 | 0.9 |
(1)a的数值为_______________.
(2)第5次实验结束后,所得到溶液中溶质的化学式为_________________.
(3)列式计算该样品中单质铁的质量分数是______________。
(4)所用稀硫酸的溶质的质量分数为____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A、B、C 三种固体物质的溶解度曲线如图所示,请回答下列问题:

①P点表示 t1℃时,____物质的溶解度相等;
②t1℃时,15 g B 物质投入50 g 水中,充分溶解,所得溶液为__________溶液(填“饱和”或“不饱和”);
③室温下,将盛有A的饱和溶液的试管放入盛水的烧杯中,再向烧杯内的水中加入一定量的NH4NO3固体并搅拌,试管内可以观察到的现象是__________;
④将 A、B、C 三种物质的饱和溶液从 t2 ℃降温到 t1 ℃时,所得溶液中溶质质量分数的大小关系正确的是__________(填序号)。
a.A>B>C b. B>A>C c. B>A=C
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图为甲、乙两种物质(均不含结晶水)的溶解度曲线图。请回答下列问题。
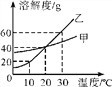
(1)在10 ℃时,甲的溶解度_____乙的溶解度。(选填“>”“<”或“=”)
(2)在20 ℃时,向盛有50 g水的烧杯中加入25 g甲物质,充分搅拌后溶液质量是____g。
(3)取乙进行如图实验,属于饱和溶液的是_____,溶质质量分数最大的是________。(选填字母序号)
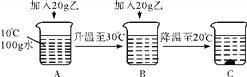
【答案】 > 70 AC B
【解析】根据溶解度曲线可知,(1)在10℃时,甲的溶解度大于乙物质的溶解度;(2)在20℃时,向盛有50g水的烧杯中加入25g甲物质,充分搅拌后溶液质量是70g,因为根据溶解度的数值50g水中只能溶解20g的甲物质;(3)根据题中提供的信息可知AC溶液为饱和溶液。
【题型】填空题
【结束】
25
【题目】溶液在生产、生活中起着十分重要的作用。请回答下列问题。
(1)可以作为溶质的是__________。
A.只有固体 B.只有液体 C.只有气体 D.气体、液体、固体都可以
(2)配制100 g质量分数为16%的氯化钠溶液,所需氯化钠的质量为__________,水的体积为________mL(水的密度近似看作1 g/cm3)。
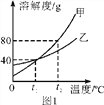
(3)甲、乙两种不含结晶水的固体物质的溶解度曲线如图1。t1 ℃时,甲物质的溶解度是___________。t2 ℃时,若从甲和乙两种物质的饱和溶液中析出等质量的固体,须蒸发掉较多水的是___________(填“甲”或“乙”)物质的饱和溶液。
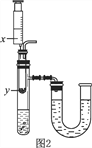
(4)按图2所示装置,将液体x注入装有固体y的试管中,会导致U形管中右端液面升高,则可能的组合是___________。
选项 | x | y |
A. | 水 | 氧化钙 |
B. | 水 | 硝酸铵 |
C. | 浓硫酸 | 水 |
D. | 稀盐酸 | 镁 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】科学家最新发现,通过简单的化学反应,可以将树木纤维转变成超级储能装置,如图是该反应的微观示意图,下列说法正确的是(______)
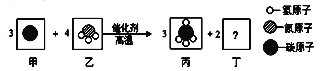
A、丁的化学式为N2 B、丙中碳元素的质量分数为50%
C、该反应不符合质量守恒定律 D、该反应属于___________反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】煤、石油、天然气等化石燃料将日趋枯竭,新能源的开发与开采迫在眉睫。我国于2017年5月28日在南海宣布可燃冰试开采成功,这标志着我国成为全球第一个实现在海域开采可燃冰的国家。可燃冰是一种高效清洁,储量巨大的新能源,是由天然气与水在高温低压下形成的类冰状结晶物质。
(1)请写出天然气(主要成分CH4)完全燃烧的化学方程式:_______________ ;
(2)物质的燃烧也会带来安全隐患,下列处理火灾事故的方法中正确的是_________(填字母序号)。
A.家用电器着火,用水扑灭 B.档案资料着火,可用液态二氧化碳扑灭
C.室内起火,迅速打开所有门窗通风 D.高层楼房失火时,要乘电梯迅速撤离
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某兴趣小组同学做如下图所示探究分子运动的实验,回答下列有关问题。

(1)实验Ⅰ:在盛有少量蒸馏水的小烧杯中滴入2~3滴酚酞试液,无明显现象;再向其中滴加浓氨水,溶液变红色。由实验Ⅰ得出的结论有_____________________________。
(2)实验Ⅱ:(如图甲所示)烧杯B中的现象是溶液慢慢变红色;产生这一现象的原因是:________________。
(3)为使实验结论准确可靠,该兴趣小组的同学设计实验Ⅲ(如图乙所示)作为对比实验。你认为有无必要?________理由是________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碳和碳的氧化物与我们的生活密切相关,请依据下图回答问题:

(1)图1是碳原子结构示意图,其原子核内质子数为________,该元素在元素周期表中位于第_____周期。
(2)碳元素组成不同碳单质有广泛的用途,图2中用到的碳单质是________,图3中用到的碳单质是____,图4中用到的碳单质是________;不同碳单质物理性质存在明显差异的原因是_____________。
(3)CO和CO2是碳的两种氧化物。
CO可作燃料,其在空气中燃烧的化学方程式是________________。
CO2可制饮料,其和水反应的化学方程式是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com