
【题目】根据如图中a、b、c三种物质的溶解度曲线,回答下列问题:
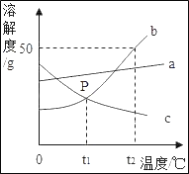
(1)P点表示在t1℃两物质的溶解度关系为b_____c(填“>”、“<”或“=”).
(2)t2℃,a、b、c三种物质的饱和溶液溶质质量分数的大小关系为_____.
(3)t2℃时,50g b物质加入到50g水中充分溶解后,所得溶液的质量为_____.
(4)b中含有少量的a,若要提纯b,可采用_____结晶的方法.把c物质的不饱和溶液变为饱和溶液,下列有关说法不正确的是_____ (填序号,下同)
A 溶剂的质量可能变小
B 溶质的质量一定不变
C 溶质的质量分数可能变大
D 溶液的质量可能变小
E 该饱和溶液还可以溶解其它物质
(5)把100g质量分数为98%的浓硫酸稀释成10%的稀硫酸,需要水的质量是_____g.
【答案】= b>a>c 75g 降温 B 880
【解析】
(1)溶解度曲线的交点表示该温度下两物质的溶解度相等;
(2)饱和溶液中溶质质量分数的计算式![]() ×100%,即溶解度大则溶质的质量分数大;
×100%,即溶解度大则溶质的质量分数大;
(3)据该温度下b的溶解度分析解答;
(4)据物质的溶解度随温度变化情况分析提纯物质的方法;c的溶解度随温度升高而减小,所以使其不饱和溶液变为饱和溶液,可采取加入溶质、蒸发溶剂、升温的方法,并结合饱和溶液概念及选项解答;
(5)稀释过程中溶质的质量不变.
(1)P点是t1℃两物质的溶解度曲线 的交点,表示二者的溶解度关系是:b=c;
(2)t2℃,a、b、c三种物质的溶解度大小关系是:b>a>c,饱和溶液中溶解度大则溶质的质量分数大,故饱和溶液溶质质量分数的大小关系为 b>a>c;
(3)t2℃时b的溶解度是50g,即100g水中最多溶解50g的b,所以50g b物质加入到50g水中充分溶解后,最多溶解25g,故所得溶液的质量为 75g;
(4)a的溶解度受温度影响不大,b的溶解度受温度影响较大,所以b中含有少量的a,若要提纯b,可采用 降温结晶的方法;
把c的溶解度随温度升高而减小,所以使其不饱和溶液变为饱和溶液,可采取加入溶质、蒸发溶剂、升温的方法;
A.若采取蒸发溶剂的方法,则溶剂的质量变小,正确;
B.若采取升温至恰好饱和的方法,则溶液中溶质的质量不变,故错误;
C.若采取蒸发溶剂的方法,则溶剂的质量变小,溶质的质量不变,溶质的质量分数变大,正确;
D.蒸发溶剂的方法,则溶剂的质量变小,溶液的质量变小,正确;
E.c的饱和溶液是该温度下再加入c不能溶解,但还可以溶解其它物质,是其他物质的不饱和溶液,正确;
(5)把100g质量分数为98%的浓硫酸稀释成10%的稀硫酸,设需要水的质量是x,则有100g×98%=(100g+x)×10%,解得x=880g;
故答案为:(1)=;(2)b>a>c;(3)75g;(4)降温;B;(5)880.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:初中化学 来源: 题型:
【题目】钢铁是人类广泛使用的金属材料,请完成下列填空。
(1)工业上用一氧化碳与赤铁矿(主要成分Fe2O3)反应来炼铁,其反应方程式是______。
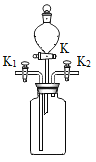
(2)如图所示装置可用于研究铁生锈的条件,取两套相同的装置,分别放入干燥的铁丝和潮湿的铁丝。将两套装置都进行如下操作:关闭K,打开K1和K2,从K1处通入氧气,使瓶中充满氧气后关闭K1和K2,一段时间后对比观察铁丝的变化,两组实验对比的目的是:____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是实验中用于制取和收集气体的装置图,请回答以下问题。
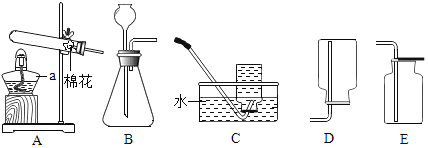
(1)写出图中仪器a的名称:_____;
(2)实验室常用氯酸钾和二氧化锰制取并收集氧气装置应选择的是_____(填字母序号),发生反应的化学方程式为_____;
(3)实验室制取二氧化碳选用的发生装置是_____(填字母序号),发生反应化学反应方程式为_____;
(4)诺贝尔奖得主穆拉德教授在《神奇的一氧化氮》书中提出:“人体中99.9%的疾病与一氧化氮有关”。已知一氧化氮气体难溶于水,常温下极易与氧气反应,现在实验室中要收集一瓶一氧化氮,选用的装置是_____(填字母序号)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某研究小组对自动充气气球(示意图如下)进行下列探究。
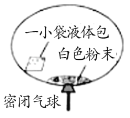
(查阅资料)该反应充气原理是:通过挤破液体包,使液体与白色粉末接触产生二氧化碳气体,实现气球自动充气。
(1)通常用澄清的石灰水来检验气体是二氧化碳,该反应的化学方程式 为_____。
(2)室温时,用pH试纸测得溶液的pH=3,该溶液呈_____性。
(3)探究白色粉末成分:
(猜想与假设)甲同学认为是碳酸钙;乙同学认为是碳酸钠;丙同学认为是碳酸氢钠。
(设计并进行实验)
实验一:完成下表:
操作步骤 | 现象 | 结论 |
_____ | _____ | 甲同学的猜想不正确 |
实验二:室温时,分别向盛有碳酸氢钠、碳酸钠和白色粉末样品的锥形瓶中注入等体积、足量的稀盐酸,并测量生成二氧化碳的体积(装置如图),记录如下表:
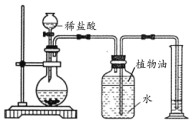
实验编号 | 锥形瓶内物质 | 最终得到CO2体积/mL | |
名称 | 质量/g | ||
① | 碳酸氢钠 | 0.8 | V1 |
② | 碳酸钠 | 0.8 | V2 |
③ | 白色粉末 | a | V1 |
(4)实验装置中植物油的作用是_____;表中a=_____;V1_____V2(填“﹥”、“﹤”或“=”)。
(分析并得出结论)
(5)分析上表中数据得出结论:白色粉末的成分是_____,依据是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小明同学测定该胃药中NaHCO3含量的过程如下,取10粒该药剂研碎后放入烧杯中,加入50g水后充分搅拌,再向其中滴加11.5克稀盐酸恰好反应(药品中的其它成分既不溶于水,也不与稀盐酸反应),形成NaCl的不饱和溶液,称得反应后烧杯内物质的总质量为64.3克。求:

(1)反应完成后生成气体的质量_____
(2)求该药品中NaHCO3的质量分数_____
(3)求反应后所得溶液的溶质质量分数_____(精确到0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水是生命之源
(1)图B所示是净化水的简易装置,其中能起到吸附作用的是_____,小卵石和砂子起到作用_____。
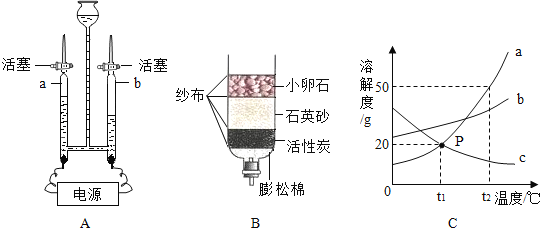
(2)用如图A装置进行电解水的实验,a、b两管中都收集到气体,质量比为_____,b中的气体是_____,打开活塞,点燃b中气体,产生的现象是_____。写出电解水反应的化学方程式_____。
(3)如图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点。据如图C回答:
①t2℃时30g a物质加入到50g水中不断搅拌,形成的溶液中溶质的质量分数是_____;
②t2℃时a、b、c三种物质的溶解度按由小到大的顺序排列是_____。
③在t2℃时,将等质量的a、c饱和溶液同时降温至t1℃时,对所得溶液的叙述正确的是_____(填序号)。
A a和c都是饱和溶液 B 所含溶剂质量a<c C 溶液的质量a>c D 溶质的质量分数a>c
(4)将30g铁片放入CuSO4溶液中片刻后,取出称量铁片质量为31.6g,则参加反应的铁的质量为_____克。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列说法正确的是( )
A.等质量的镁与氧化镁混合,其混合物中镁、氧两种元素的质量比为5:2
B.铁和锌的混合物6g与足量的稀盐酸反应,生成氢气的质量可能为0.2g
C.将100mL 50%的某溶液与100mL水混合,所得溶液的溶质质量分数一定为25%
D.现有氧化铜和氧化铁的混合物10g与100g溶质质量分数为14.7%的稀硫酸恰好完全反应,则混合物中氧元素的质量分数为24%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】家庭中长期使用的热水壶底部有一层水垢,主要成 分是碳酸钙和氢氧化镁,可用酸溶液来清除水垢。小明同学想通过实验测定水垢中碳酸钙的含量,他将过量的稀盐酸加入到200 g水垢中(假定水垢中杂质不与酸反应),并将产生的CO2气体全部通入到足量的NaOH溶液中(不考虑盐酸的挥发性),NaOH溶液增加的质量与反应时间的关系如图所示,
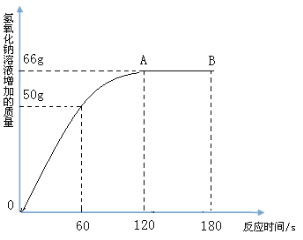
试根据题意回答下列问题:
(1)在滴入稀盐酸的过程中,观察到的一项明显现象是 。
(2)从图中可知,NaOH溶液吸收的CO2气体的总质量为_______g。
(3)在水垢中加入稀盐酸时,所发生的中和反应的化学方程式为 。
(4)计算水垢中碳酸钙的质量分数(写出相应的计算过程,结果精确到0.1%)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某兴趣小组在实验室里准备常见酸、碱、盐的性质实验时,发现实验台上摆放的药品中,有一瓶未盖瓶塞且标签破损的溶液(如图),他们决定对这瓶溶液的成分进行探究。

(提出问题)这瓶溶液的溶质是什么?
(获得信息)
(1)酸、碱、盐的性质实验中用到含钠元素的物质有氯化钠、氢氧化钠、碳酸钠、碳酸氢钠。
(2)实验室里盛放碱性溶液的试剂瓶通常使用橡胶塞。
(3)碳酸氢钠溶液与氯化钡溶液不反应;氯化钡溶液呈中性。
(提出猜想)猜想一:氢氧化钠; 猜想二:碳酸钠; 猜想三:碳酸氢钠。
(实验探究)
(1)小军取样滴加稀盐酸有_____产生,得出结论:该溶液的溶质是碳酸钠或者是_____,可能发生的化学反应方程式:_____(任写一个)。
(2)小军另取样加入过量的氯化钡溶液,观察到有_____产生,进而得出结论:该溶液的溶质是碳酸钠。
(3)小华认为小军的结论不完全正确,理由是_____,其化学方程式为_____。
小组同学讨论后一致认为还需要进行如下实验:
(4)取小军第二次实验后的上层清液,滴入无色酚酞溶液,溶液呈红色。
(实验结论)这瓶溶液的原溶质是_____。
(探究启示)实验中取用液体药品时,应注意_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com