在电解水的实验中,为了加快电解的速度,可先向水里加入少量H2SO4,混匀后注入水电解装置.
(1)H2SO4的摩尔质量是______.
(2)若水电解装置中盛有4.82%的H2SO4溶液100g,通电一段时间后切断电源,水的质量减少了3.6g.(已知通电时H2SO4不发生变化,其他损失忽略不计.)
Ⅰ.计算生成O2的物质的量(根据化学方程式列式计算).
Ⅱ.此时溶液中溶质H2SO4的质量分数为______.
解:(1)硫酸的化学式为H
2SO
4H
2SO
4的摩尔质量=1×2+32+16×4=98g/mol
(2)Ⅰ.水的质量减少了3.6g,则有3.6g水,0.2mol水被电解
设电解3.6g水可生成氧气的物质的量为n
2H
2O

2H
2↑+O
2↑
2 1
0.2mol n
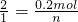
解之得 n=0.1mol
答:生成O
2的物质的量为0.1mol
Ⅱ.电解水,溶液中硫酸的质量不变
此时溶液中溶质H
2SO
4的质量分数=
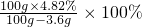
=5.00%
故答案为:5.00%
分析:(1)根据化学式,计算摩尔质量;
(2)I.根据反应的化学方程式,由消耗水的质量计算生成氧气的质量;
II.分析溶液质量的变化,计算剩余溶液中溶质的质量分数.
点评:纯净的水导电能力很差,可在水中加入硫酸或氢氧化钠增强水的导电性,电解水时加入的物质不变.

 2H2↑+O2↑
2H2↑+O2↑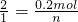
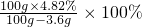 =5.00%
=5.00%

 名校课堂系列答案
名校课堂系列答案