
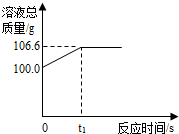
 为测定某赤铁矿石中氧化铁的质量分数,某化学兴趣小组的同学用过量的一氧化碳与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的气体用100g氢氧化钠溶液恰好完全吸收,形成不饱和溶液.该溶液总质量与反应时间的变化关系如图.试分析解答:
为测定某赤铁矿石中氧化铁的质量分数,某化学兴趣小组的同学用过量的一氧化碳与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的气体用100g氢氧化钠溶液恰好完全吸收,形成不饱和溶液.该溶液总质量与反应时间的变化关系如图.试分析解答: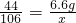


科目:初中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:初中化学 来源:2013年江苏省南京市鼓楼区中考二模化学试卷(带解析) 题型:计算题
某同学为测定10g某赤铁矿石中氧化铁的质量分数,利用稀硫酸和锌粒制取氢气,设计了下图所示的装置,进行有关的实验探究(提示:3H2+Fe2O3 2Fe+3H2O;杂质不参加反应,假定每步均完全反应或吸收)。请回答有关问题:
2Fe+3H2O;杂质不参加反应,假定每步均完全反应或吸收)。请回答有关问题:
得到如下数据:
| 装置 | B | C |
| 反应前质量 | 84.3g | 294.1g |
| 反应后质量 | 81.9g | 296.8g |
查看答案和解析>>
科目:初中化学 来源:2013年江苏省南京市鼓楼区中考二模化学试卷(解析版) 题型:计算题
某同学为测定10g某赤铁矿石中氧化铁的质量分数,利用稀硫酸和锌粒制取氢气,设计了下图所示的装置,进行有关的实验探究(提示:3H2+Fe2O3 2Fe+3H2O;杂质不参加反应,假定每步均完全反应或吸收)。请回答有关问题:
2Fe+3H2O;杂质不参加反应,假定每步均完全反应或吸收)。请回答有关问题:

得到如下数据:
|
装置 |
B |
C |
|
反应前质量 |
84.3g |
294.1g |
|
反应后质量 |
81.9g |
296.8g |
(1)请计算该赤铁矿石样品中氧化铁的质量分数。(写出计算过程)
(2)该实验还可测定组成水中各元素之间的质量关系,请用表中实验数据列式表示出水中氢、氧元素的质量比为_______________________________________________(只列式,不计算);若玻璃管中的氧化铁没有完全反应,则求得水中氢、氧元素的质量比会__________(选填“偏大”、“偏小” 或“不变”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
某同学为测定10g某赤铁矿石中氧化铁的质量分数,利用稀硫酸和锌粒制取氢气,设计了下图所示的装置,进行有关的实验探究(提示:3H2+Fe2O3 2Fe+3H2O;杂质不参加反应,假定每步均完全反应或吸收)。请回答有关问题:
2Fe+3H2O;杂质不参加反应,假定每步均完全反应或吸收)。请回答有关问题:
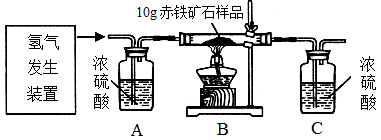
得到如下数据:
| 装置 | B | C |
| 反应前质量 | 84.3g | 294.1g |
| 反应后质量 | 81.9g | 296.8g |
(1)请计算该赤铁矿石样品中氧化铁的质量分数。(写出计算过程)
(2)该实验还可测定组成水中各元素之间的质量关系,请用表中实验数据列式表示出水中氢、氧元素的质量比为_______________________________________________(只列式,不计算);若玻璃管中的氧化铁没有完全反应,则求得水中氢、氧元素的质量比会__________(选填“偏大”、“偏小” 或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com