
用“侯氏联合制碱法”制得的纯碱常含有少量的氯化钠.为测定某纯碱样品中碳酸钠的含量,小明称取该纯碱样品3.3g,充分溶解于水中,再滴加氯化钙溶液,产生沉淀的质量与加入氯化钙溶液的质量关系如图所示.求:
(1)该纯碱样品中碳酸钠的质量分数。(精确到0.1%)
(2)所加入氯化钙溶液的溶质质量分数。
 应用题作业本系列答案
应用题作业本系列答案科目:初中化学 来源: 题型:计算题
实验室有瓶存放一段时间的氢氧化钠固体,部分已变质为碳酸钠.取2.00g该固体,先加水充分溶解,再加入足量澄清石灰水,生成1.00g碳酸钙沉淀.计算:
(1)2.00g该固体中碳酸钠的质量;
(2)该氢氧化钠固体的变质程度.(计算结果保留到1%)
(提示:氢氧化钠的变质程度是指已变质的氢氧化钠占变质前氢氧化钠的质量分数)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
一瓶久置的氢氧化钠固体已经发生了变质,某研究小组为了探究氢氧化钠的变质纯度,作出如下猜想:猜想一、可能部分变质,固体是NaOH和Na2CO3的混合物;猜想二、可能全部变质,固体是Na2CO3。
(1)首先对固体的成分进行确定。取少量固体于试管中,加水充分溶解,先加入足量的BaCl2溶液,产生白色沉淀,静置后取上层溶液,再加入CuSO4溶液,产生蓝色絮状沉淀。根据实验现象,可判断 是正确的。
(2)称取10.6克该固体样品于锥形瓶中,加入一定质量分数的稀盐酸,直至过量,得到数据如下表:
| 样品质量 | 反应前总质量 | 反应后总质量 |
| 10.6克 | 148.5克 | 146.3克 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
某校兴趣小组同学收集到含有硝酸银的溶液10g,他们利用铁锌合金回收其中的金属银,其实验过程如图所示。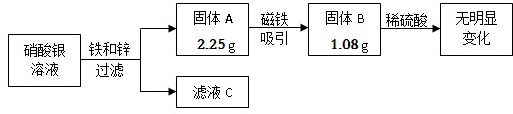
(1)固体A的成分是 (填化学式);滤液C中一定含有的溶质是 (填化学式)。
(2)写出铁与硝酸银反应的化学方程式: 。
(3)计算硝酸银的相对分子质量 ;原硝酸银溶液中溶质的质量为 。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
称取硝酸钠和硝酸银的固体混合物40g,放入烧杯中,加入188.7g氯化钠溶液恰好完全反应。待反应完全后过滤,称得滤液的质量为200g。计算:
(1)原固体混合物中的硝酸银的质量为多少?
(2)所得滤液中溶质的质量分数为多少?
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
某同学对实验室中失去标签的石灰石样品进行纯度(样品中碳酸钙的质量分数)测定,取这种石灰石样品12.5g,加入94.4g一定质量分数的稀盐酸.充分反应后,共收集到4.4g二氧化碳气体(石灰石中的杂质既不溶于水,也不和稀盐酸反应).求:
(1)石灰石样品中碳酸钙的质量分数.
(2)反应后所得溶液中溶质的质量分数.
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
将氯化钙和碳酸钙的混合物12g放入一个烧杯中,然后往其中加入123.4g稀盐酸,恰好完全反应,称量反应后剩余物质的总质量为131g.计算:
(1)生成二氧化碳的质量是多少?
(2)反应后所得溶液中溶质的质量分数是多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com