小明家购买了一瓶白醋,标签上注明醋酸的质量分数≥5%.小明想,这瓶白醋中醋酸的含量是否与标签的标注相符?小明于是用有关酸碱的知识做了如下实验:实验步骤①先用量筒取12mL白醋(密度近似为1.0g/mL)倒入烧杯中,再加入20mL蒸馏水稀释.②量取45.0mL溶质质量分数为1.0%(密度近似为1.0g/mL)的氢氧化钠溶液,逐滴的滴加到稀释后的白醋中,同时不断搅拌烧杯中的溶液.滴至恰好完全反应,剩余氢氧化钠溶液5.0mL.(反应原理:CH3COOH+NaOH═CH3COONa+H2O )
请问:(1)CH3COOH中C、H、O的原子个数比为:______;
(2)该瓶白醋中溶质的质量分数为多少?
解:(1)利用化学式中原子的个数关系解决:故答案为:1:2:1
(2)解:由题知,实际参加反应的氢氧化钠质量为:(45.0-5.0)mL×1.0g/mL×1.0%=0.4g
设该瓶白醋中溶质的质量分数为x
CH
3COOH+NaOH═CH
3COONa+H
2O
60 40
x 0.4g
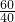
=

x=0.6g
则醋酸的溶质质量分数是:

×100%=5%
答:该瓶白醋中溶质的质量分数为5%.
分析:(1)利用化学式中各原子的个数比等于各元素符号右下角角码的比,求解时要注意一个化学式中各元素原子的分布.
(2)首先计算出反应时氢氧化钠的质量,再利用化学方程式进行已知一个反应物求另一个反应物的计算.
点评:此题是对醋酸有关知识的考查,涉及到醋酸分子的意义及常规的化学方程式的计算,计算的形式是已知一个反应物求另一个反应物.

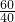 =
=
 ×100%=5%
×100%=5%