
【题目】化学使世界变得更加绚丽多彩,人类的衣食住行都和化学密不可分
(1)现有H、C、O、Ca四种常见元素,请选用其中的元素写出符合要求的物质各一种(用化学式表示):
①我市绿色公交车使用的燃料“CNG”中主要气体 ;
②常用补钙剂的盐类__________;
③碳酸饮料中的酸 ;
④可用于炼钢的气体是 。
(2)人类生活生产离不开金属,不仅因为其物理性能优良,还与化学性质密切相关。
①钛被称为“21世纪金属”,呈灰色,能在氮气中燃烧,熔点高。钛和钛合金是新型的结构材料,主要用于航天和航海工业。上述描述中属于钛化学性质的是 。
②某小组用图1所示装置对铁生锈的条件进行探究。4min后发现A中铁钉表面灰暗,B中铁钉依然光亮,对比A、B现象说明:决定铁生锈快慢的一个重要因素是 。

③在金属活动顺序表中,金属位置越靠前,越容易失去电子。Ca、 Mg、 K三种金属失电子能力由弱到强的顺序是 ,如上图2是三种原子的结构示意图,据此推测金属失电子能力的强弱除与最外层电子数有关外,还可能与 有关。
【答案】(1)① CH4; ②CaCO3; ③ H2CO3; ④O2 。
(2)①能在氮气中燃烧;②氧气浓度;③Mg<Ca<K,电子层数
【解析】
试题分析:(1)①绿色公交车使用的燃料“CNG”中主要气体是CH4; ②常用补钙剂的盐类是CaCO3;
③碳酸饮料中的酸是H2CO3; ④可用于炼钢的气体是氧气,能提高钢的产量和质量 (2)①能在氮气中燃烧描述的是钛的化学性质 ②A试管内氧气的浓度大于B试管内空气中氧气的浓度,通过对比实验可知决定铁生锈快慢的一个重要因素是氧气浓度 ③ 钾、钙、钠三种金属的活动性顺序由弱到强的顺序是Mg<Ca<K ,钙和镁最外层都是2个电子,钙有4个电子层,Mg有3个电子层,但是Ca>Mg,说明金属失电子能力的强弱除与最外层电子数有关外,还可能与电子层数有关。


科目:初中化学 来源: 题型:
【题目】“微观﹣宏观﹣符号”是化学独特的表示物质及其变化的方法.

(1)构成物质的粒子之间的关系如图1所示.
①甲是 ;
②在氨气、金刚石和硫酸铜三种物质中,由分子构成的物质是 .
(2)根据如图2的信息填空:甲图中所示元素原子的核电荷数是 ,铝和氧两种元素形成化合物的化学式是 ,丙图所示粒子符号是 .
(3)甲和乙在高温高压、催化剂条件下反应生成丙,三种物质微观结构示意图如图3,该反应中参加反应的甲和乙的质量比为 .
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列叙述中不正确的是( )
A.化学是研究物质的组成、结构、性质以及变化规律的科学
B.化学是一门以实验为基础的科学
C.阿伏加德罗发现元素周期律和周期表
D.化学使世界变得更加绚丽多彩
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列有关物质的鉴别、检验、除杂所用的试剂或方法正确的是( )
选项 | 实验目的 | 所用试剂或方法 |
A | 鉴别氯化钠溶液和稀盐酸 | 无色酚酞 |
B | 鉴别硫酸钠溶液和硝酸钾溶液 | 氯化钡溶液 |
C | 除去氧化钙中的少量碳酸钙 | 加水溶解后过滤 |
D | 除去二氧化碳中的HCl | 氢氧化钠溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】炼铁产生的废渣中含有大量CuS及少量铁和铁的化合物,工业上以该废渣为原料生产CuCl2的流程图如下:

(1)操作1把废渣粉碎的目的 。
(2)在废渣粉末中加入NaCl和O2的目的是:CuS、NaCl和O2在高温条件下反应生成CuCl2和Na2SO4,写出该反应的化学方程式 。
(3)【查阅资料】:不同金属氢氧化物可以在不同的pH范围内从溶液中沉淀析出,工业上利用调节溶液pH的方法,使金属氢氧化物依次沉淀,结合过滤等操作,进行物质分离。下表是氢氧化铁与氢氧化铜开始沉淀与沉淀完全的pH
Fe(OH)3 | Cu(OH)2 | |
开始沉淀的pH | 1.9 | 4.7 |
沉淀完全的pH | 3.2 | 6.7 |
操作3的名称是 ,其中用到玻璃棒的作用是 。在此操作之前,为了使溶液中的Fe3+变成Fe(OH)3沉淀而除去,你认为调节溶液的pH到 (填数值范围)比较合适。
(4)流程图中能循环利用的物质是 和水。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】纯碱是重要的化工原料
(一)制备探究:如图是工业生产纯碱的主要流程示意图.

[查阅资料]
①粗盐水中含有杂质MgCl2、CaCl2;
②常温下,NH3极易溶于水,CO2能溶于水,
③NaHCO3加热易分解,Na2CO3加热不易分解.
(1)写出除去粗盐水中MgCl2的化学方程式: 。
(2)在工业生产纯碱工艺流程中,先“氨化”后“碳酸化”的目的是 ,“碳酸化”时,NaCl、NH3、CO2 和H2O相互作用析出NaHCO3,写出该反应的化学方程式 。
(3)“碳酸化”后过滤获得的NH4Cl可用作氮肥,也可先加热NH4Cl溶液,再加入熟石灰获得循环使用的物质是 ;
(4)煅烧制得纯碱的化学方程式是 。
(二)成分探究
[提出问题]纯碱样品中含有哪些杂质?
[猜想]
猜想一:可能含有NaHCO3; 猜想二:可能含有NaCl;猜想三:NaHCO3和NaCl
[实验探究]确定纯碱中是否含NaHCO3.实验装置和主要实验步骤如下:

①称量D、E装置总质量为200.0g,检查装置的气密性,将10.6 g纯碱试样放入锥形瓶中,按上图组装仪器,进行如下操作 ,后缓缓鼓入一段时间空气;
②按一定要求正确操作后,加入足量稀硫酸,待锥形瓶中不再产生气泡时,再次打开止水夹K1,从导管a处再次缓缓鼓入空气;
③一段时间后再次称量装置D、E的总质量为204.84g.
[实验讨论]
(5)步骤①中“如下操作”是指 ;
(6)装置B中一定发生的化学反应方程式为: ;
(7)装置B中生成CO2的质量为4.84g,通过计算说明纯碱中 含NaHCO3(填字母)。(写出计算过程)
A.一定 B.一定不 C.可能 D.无法确定
(8)另取10.6 g样品,加入a g 14.6%的盐酸恰好完全反应,再将所得溶液蒸干后得到固体的质量为W,当W的值满足 条件时,样品中含有NaCl。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下列对各反应的描述,既是化合反应又是氧化反应的是( )
A、将生石灰(氧化钙)投入水中生成熟石灰(氢氧化钙);
B、酒精燃烧生成二氧化碳和水;
C、氢气燃烧生成水;
D、向硫酸铜溶液中滴加氢氧化钠溶液生成蓝色氢氧化铜沉淀。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】管道烟泥中含有某些单质,其中Cu约占10.3%、Zn约占5.0%、S约占1.2%。在加热的条件下,Zn、Cu都可以与氧气反应生成相应的金属氧化物;现欲回收铜和锌,并对硫进行环保处理,主要步骤如下图所示。下列说法正确的是:( )
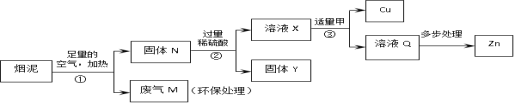
A.②、③中的操作若在实验室中完成,用到的仪器有烧杯、玻璃棒、漏斗和酒精灯
B.溶液X中ZnSO4的质量大于CuSO4的质量
C.步骤①中即使空气不足量,也不会导致锌的回收率降低
D.①产生的废气M可以用石灰乳处理,反应方程式是SO2+Ca(OH)2=CaSO4+H2O
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】潍坊市濒临渤海湾,海洋资源丰富,开发前景十分远大。
(1)利用海洋中的贝壳及食盐可以制得纯碱,我国制碱工业先驱侯德榜发明了“侯氏制碱法”。其模拟流程如下:

反应①的化学方程式 ,反应②的化学方程式为 。工业上用分离液态空气的方法制取氮气,属于 变化(填“物理”或“化学”)。
(2)金属镁广泛应用于生活、生产和国防工业。从海水中提取镁的过程如图所示:
![]()
在上述转化过程中,①处所发生的反应属于四种基本反应类型中的 反应,镁元素的化合价发生变化的是 反应(填写反应序号)。
(3)海水中除了蕴含大量的钠元素和镁元素外,还含有大量的钾元素。
运用溶解度表与溶解度曲线回答下列问题:


①氯化钠的溶解度曲线是 (填“甲”或“乙”)。
②60℃时,100g 水中加入90g 硝酸钾,充分溶解,所得溶液是 (填“饱和”或“不饱和”)溶液。当60℃的该溶液降温到10℃时,析出晶体的质量为 g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com