
 下面是利用如图装置完成验证二氧化碳性质的实验.
下面是利用如图装置完成验证二氧化碳性质的实验.

科目:初中化学 来源: 题型:
| A、HNO3 |
| B、HCl |
| C、BaCl2 |
| D、NaOH |
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、治疗胃酸过多症 2HCl+Ca(OH)2=CaCl2+2H2O 中和反应 |
| B、铁与稀硫酸反应制氯气 2Fe+3H2SO4=Fe2(SO4)3+3H2↑ 置换反应 |
| C、雨水呈酸性的原因 CO2+H2O=H2CO3 化合反应 |
| D、吸收二氧化气体 CO2+2NaOH=Na2CO3+H2O 复分解反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 根据A物质和B物质的溶解度曲线(如图),回答下列问题:
根据A物质和B物质的溶解度曲线(如图),回答下列问题:| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 溶解度/g | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
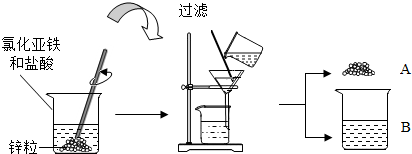
查看答案和解析>>
科目:初中化学 来源: 题型:
 溶液不是NaNO3,为确定其成分,某同学进行如下研究.
溶液不是NaNO3,为确定其成分,某同学进行如下研究.| 实验步骤 | 步骤一 | 步骤二 | 步骤三 |
| 实验过程 | 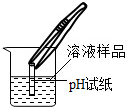 | 用洁净的铂丝蘸取该溶液放在火焰上,观察 |  |
| 实验现象 | 试纸变色,对照色卡,pH=7 | 火焰呈黄色 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com