
【题目】乙炔是一种常见的有机燃料,将乙炔在纯氧气中燃烧后进行以下实验,已知①含碳元素的物质完全燃烧形成CO2,不完全燃烧生成CO;②白色无水CuSO4粉末遇水变蓝色:
(1)若选用过氧化氢溶液和二氧化锰来制取纯氧气,为控制反应速率应选下面发生装置中的__________(填序号)。
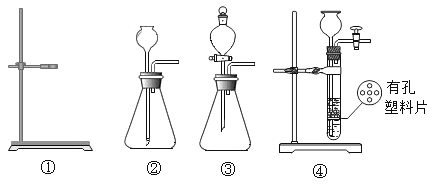
(2)将燃烧的产物依次通过A-F装置(部分夹持、固定装置省略)进行验证:若交换A、B装置的后果是___________________________。
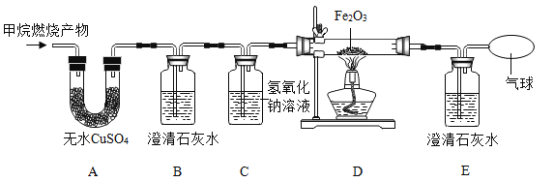
(3)实验过程中观察到A中白色粉末变为蓝色,B、E中澄清石灰水均变浑浊,D中红色粉末变成黑色,由此推断该实验中乙炔燃烧的产物是____________,实验过程中除去CO2的反应的化学方程式是_____________________。
【答案】③ 无法检验H2O H2O、CO2、CO CO2+2NaOH=H2O+Na2CO3
【解析】
(1)装置③中分液漏斗能控制液体的滴加速率,从而控制反应的速率。若选用过氧化氢溶液和二氧化锰来制取纯氧气,为控制反应速率应选下面发生装置中的③;
(2)从B中出来的气体带有水蒸气,将燃烧的产物依次通过A-F装置(部分夹持、固定装置省略)进行验证:若交换A、B装置的后果是无法检验H2O;
(3)白色无水CuSO4粉末遇水变蓝色,实验过程中观察到A中白色粉末变为蓝色,说明的水生成;二氧化碳能使澄清石灰水变溶液,B中澄清石灰水变浑浊,说明有二氧化碳生成;一氧化碳与氧化铁在高温条件下能生成铁和二氧化碳,D中红色粉末变成黑色,说明有一氧化碳生成,由此推断该实验中乙炔燃烧的产物是H2O、CO2、CO。氢氧化钠与二氧化碳反应生成碳酸钠和水,实验过程中除去CO2的反应的化学方程式是CO2+2NaOH=H2O+Na2CO3。


科目:初中化学 来源: 题型:
【题目】请根据如图所示的实验回答下列问题:
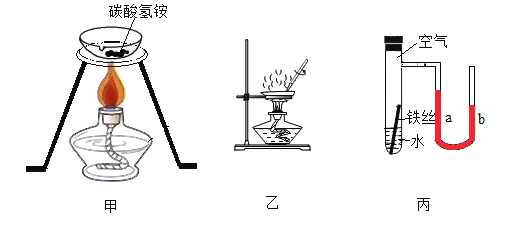
(1)甲是加热碳酸氢铵的实验。碳酸氢铵属于_____(选填“氮肥”“碳肥”或“复合肥”); 加热一会儿后,蒸发皿中固体完全消失,由此得出碳酸氢铵的一条化学性质是______。
(2)乙是蒸发氯化钠溶液的实验。当________时,停止加热。
(3)丙是验证铁丝锈蚀的实验。铁丝锈蚀的条件是_______;该实验开始时U形管两端液面相平,一段时间后,能观察到液面的变化为_____(选填“a”或“b” )下降。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】酸、碱、盐是有广泛用途的重要化合物。某化学兴趣小组的同学围绕这几类化合物进行了一系列的探究活动。
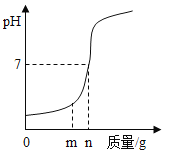
(1)用熟石灰中和一定量的盐酸时,溶液的pH与加入的熟石灰质量的关系如图所示。熟石灰与盐酸反应的化学方程式为_____;当加入熟石灰mg时,溶液中的溶质为_____。
(2)设计的趣味小实验装置如图所示,其中A、B为未膨胀的气球,C为玻璃导管,D为胶头滴管。用气密性良好的该装置分别进行甲、乙两组实验。实验时均把胶头滴管中的溶液(足量)加入到锥形瓶中,并轻轻振荡。请填写下表中的空白:
锥形瓶中的物质 | 胶头滴管中的物质 | 观察到气球(A、B)的变化 | 有关反应的化学方程式 | |
甲 | 二氧化碳 | 浓氢氧化钠溶液 | _____ | _____ |
乙 | _____ | _____ | A气球胀大,B气球无明显变化 | _____ |
(3)某工厂实验室用15%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,共消耗氢氧化钠溶液40g,洗涤后的溶液呈中性。这一定量石油产品中含H2SO4的质量是多少_____?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】阅读下列科普短文并回答问题:

纯碱的用途非常广泛。纯碱工业始创于18 世纪,西方国家对这一技术采取了严格的保密措施。一些专家想探索此项技术的秘密,均以失败告终。1943年,我国化学工程专家侯德榜针对西方纯碱生产时食盐利用率低,制碱成本高,废液、废渣污染环境和难以处理等不足,发明了侯氏制碱法又称联合制碱法。
发明原理
第一步:氨气与水和二氧化碳反应生成一分子的碳酸氢铵。先添加NH3而不是CO2:CO2在NaCl中的溶解度很小,先通入NH3使食盐水显碱性(用无色酚酞溶液检验),能够吸收大量CO2气体。
第二步:碳酸氢铵与氯化钠反应生成氯化铵和碳酸氢钠沉淀。
第三步:在5℃~ 10℃时,向母液中加入食盐细粉,而使NH4Cl单独结晶析出供做氮肥。向时液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用是:①增大NH4+的浓度,使NH4Cl更多地析出②使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度。联合法综合利用了合成氨的原料,提高了氯化钠的利用率,减少了环境污染。NH3、CO2 都来自于合成氨工艺:这样NH4Cl就成为另一产品化肥。综合利用原料、降低成本、减少环境污染,NaCl利用率达96%。
第四步:加热碳酸氢钠制取纯碱。
温度溶解度物质 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
NH4HCO3 | 11.9 | 16.1 | 21.7 | 28.4 | 36.6 | 44.1 | 59.2 |
NaHCO3 | 6.9 | 8.15 | 9.6 | 11.1 | 12.7 | 14.4 | 16.4 |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 |

阅读短文,回答下列问题:
(1)写出侯氏制碱法第二步的化学反应方程式_____。
(2)饱和食盐水中持续通入氨气和二氧化碳气体后,溶液中大量存在的离子有_____。
(3)第二步的复分解反应发生时,常温下向溶液中持续通入氨气和二氧化碳气体,碳酸氢钠以沉淀的形式先析出的原因是_____。
(4)写出侯氏制碱法的一个优点_____。
(5)循环利用的物质是_____。
(6)侯氏制碱法中没有涉及的化学反应类型是_____。
(7)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是( )
目的 | A检验溶液是否是碱溶液 | B验证氢气 |
操作 |
|
|
现象 | 溶液变蓝 | 气体燃烧,烧杯内壁有水雾 |
结论 | 该溶液为碱溶液 | 该气体为氢气 |
目的 | C研究溶解吸放热 | D除去H2中HCl气体 |
操作 |
|
|
现象 | 红墨水液面左端下降右端上升 | 瓶中长导管口有气泡冒出 |
结论 | NaOH固体溶解放热 | 获得纯净的氢气 |
A.AB.BC.CD.D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下列实验装置图回答问题:
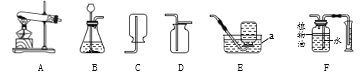
(1)写出图中仪器a的名称:________。
(2)实验室用高锰酸钾制取氧气应选用的发生装置为______(填字母序号),若要收集比较纯净的氧气应选择的收集装置为______(填字母序号),写出该反应的化学方程式:_______。
(3)组装发生装置A时,下列仪器、用品的组装顺序是________(填字母序号)。
a.试管 b.酒精灯 c.铁架台 d.木块
(4)写出实验室用B装置制取二氧化碳的化学方程式______,F装置可用来测量生成CO2的体积,在水面上放一层植物油的目的是_______,植物油上方原有的空气对实验的结果_______(填“有”或“没有”)明显影响。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2019年3月30日18时许,四川省凉山州木里县雅砻江镇立尔村发生森林火灾,着火点在海拔3800余米左右。3月31日下午,扑火人员在转场途中,受瞬间风力风向突变影响,突遇山火爆燃,多名扑火人员失去联系。下列说法中错误的是( )

A.消防员所佩戴的头盔使用一种特殊的塑钢材料制成的,其中的钢材属于金属材料
B.消防员的防火服是由一种新型的耐火纤维制成的,这种纤维具有隔水透气的优点
C.消防员戴的含石棉成分的手套必须具有很好的隔热效果
D.消防员所穿的由天然橡胶制成的靴子具有耐磨,不易老化的特点
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室制取某些气体的装置图如下。请按要求回答问题。
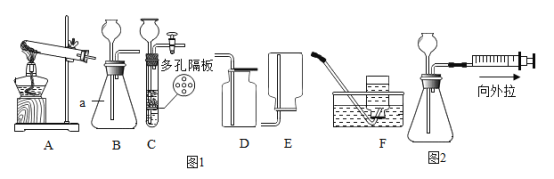
(1)写出标有序号的仪器名称:①______________;②________________。
(2)实验室用氯酸钾制取氧气的化学方程式为________________。如果忘记了加二氧化锰, 其后果是________________。
(3)实验室制取CO2时,若用C装置代替B装置作为发生装置,优点是__________;收集CO2时,为了检查气体是否收集满,采用的方法是__________。
(4)实验室制取O2和H2时,无论选择什么药品,都能选用的装置是______(填字母)。
(5)如图2所示,利用注射器可以检查装置B的气密性;先在瓶内装适量的水,使长颈漏斗下端管口液封,将活塞缓慢往外拉,若观察到_________,则装置不漏气。
查看答案和解析>>
科目:初中化学 来源: 题型:
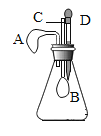
【题目】碱式碳酸铜(Cux(OH)y(CO3)z)是一种用途广泛的化工原料,实验室制取碱式碳酸铜的步骤如下。
已知:①Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+4H2O;②2NO2+2NaOH=NaNO3+NaNO2+H2O
步骤一:制Na2CO3
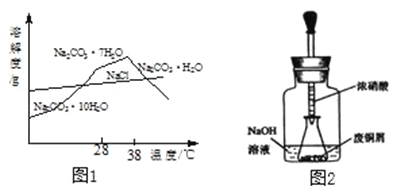
从Na2CO3溶液(含少量NaCl)提纯获得Na2CO3固体的步骤如下:蒸发浓缩,38℃以上结晶,趁热过滤,洗涤,加热脱水,得Na2CO3固体。结合如图1回答。
(1)38℃以上结晶的目的是_____。
(2)洗涤时,适宜的试剂是_____。
a热水 b冰水 c盐酸 dCa(OH)2溶液
步骤二:制Cu(NO3)2
如图2,用滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到Cu(NO3)2溶液。
步骤三:碱式碳酸铜的制备
向大试管中加入Na2CO3溶液和Cu(NO3)2溶液,水浴加热至70℃左右,用NaOH稀溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。
(3)如图装置中NaOH溶液的作用是_____。反应结束后,广口瓶内溶液中的溶质有NaOH、_____、_____(填写化学式)。
(4)步骤三中,水浴加热所需仪器有_____、_____ (加热、夹持仪器、石棉网除外);洗涤的目的是_____。
(5)影响产品产量的主要因素有_____和_____。
(6)加热碱式碳酸铜(Cux(OH)y(CO3)z)得40 g CuO和3.6 g H2O.则x:y:z=_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com