
【题目】现取8.0 g石灰石样品放在烧杯中并滴入稀盐酸,当稀盐酸滴加至36.5 g时,烧杯内物质总质量为42.3 g(气体全部逸出),产生气体的质量与加入的稀盐酸的质量关系如图所示。(友情提示:石灰石样品中的杂质不溶于水,也不发生反应)试计算 :
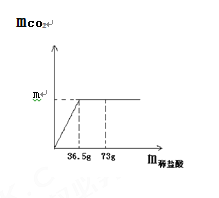
(1)m = ________。
(2)该石灰石样品中碳酸钙的质量分数是多少__________?
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组进行草酸亚铁晶体(FeC2O42H2O)分解的实验探究。
【猜 想】草酸亚铁晶体分解会产生CO、CO2和H2O三种气体。
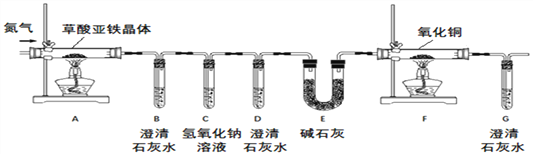
【实验方案】按照上图装置进行实验(夹持装置未画出)。
【问题讨论】(1)实验开始前需要先鼓入一段时间的N2,该操作的目的为_________;
(2)C中氢氧化钠溶液的作用是_______;
(3)E中碱石灰的作用是___________;
【结果分析】(4)定性分析:
①试管D中出现浑浊,证明产物中有_____存在;证明分解产物中存在CO的现象是_____。
②小明认为应增加H装置,则H装置应放在____两个装置之间,若观察到____,则证明有水生成;
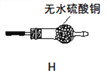
(5)定量分析(假定每一步反应进行完全):取3.6g样品进行上述实验,测得装置A硬质玻璃管中残余1.44g黑色固体FeO,装置F中硬质玻璃管固体质量减轻0.32g,则草酸亚铁晶体(FeC2O42H2O)分解得到的CO2的质量为______。
【反思评价】(6)从环保角度考虑,该套实验装置的明显缺陷是______;
(7)文献显示,FeC2O42H2O受热分解时,固体的质量随温度变化的曲线如下图所示,写出加热到400oC时,FeC2O42H2O受热分解的化学方程式_______。
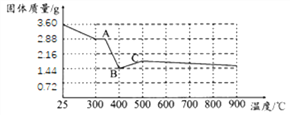
根据图像,若有3.6gFeC2O42H2O在敞口环境中充分加热,最终得到红棕色固体1.60g,则该物质的化学式为_______。由此,你认为进行该实验需要注意的事项是________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碳酸镁晶须(MgCO3·nH2O,n = 1~5的整数)是一种新型吸波隐形材料中的增强剂。
(查阅资料)(1) MgCO3·nH2O微溶于水;
(2) MgCO3·nH2O在230℃时开始失去结晶水, 400℃以上时开始分解生成三种氧化物。
I.合成碳酸镁晶须
步骤:①配制一定溶度的MgSO4溶液和NH4HCO3溶液;②量取一定量的NH4HCO3溶液于容器中,搅拌并逐滴加入MgSO4溶液,控制温度50℃,反应一段时间;③用氨水调节溶液pH至9.5,放置1h后,过滤、洗涤、干燥得碳酸镁晶须产品。
(1)步骤①配制一定溶质质量分数的MgSO4溶液所需要的玻璃仪器有烧杯、胶头滴管、玻璃棒、______________;
(2)步骤②反应的温度控制在50℃,较好的加热方法是__________;
(3)氨水、硫酸镁、碳酸氢铵三者反应,除生成MgCO3·nH2O沉淀外,同时生成的产物还有______________;
(4)检验沉淀已洗涤干净的方法是:取最后一次洗涤的滤液,滴入_________,若无沉淀说明已洗涤干净。
(5)干燥得碳酸镁晶须产品温度不能过高,目的是______________。
II.测定产品MgCO3.nH2O中的n值
(方案一)将碳酸镁晶须放入A装置中加热(仪器和装置如下图所示),回答下列问题:
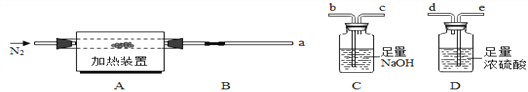
(6)上述装置的连接顺序为_____(按气流方向,用接口字母表示),其中B处的长玻璃导管的作用是__________,C装置的作用是__________。
(7)加热前先通入N2排尽装置中的空气,然后称取C、D的初始质量。再次连接好装置,边加热边通入N2,此时通入N2的作用是_____________。
(8)若B装置中无残留物。装置C反应前后质量差为m1,装置D反应前后质量差m2 。根据以上实验数据,确测定n值, n=___(用含m1、m2的代数式表示)。
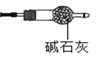
(9)有同学提出上述连接好的装置仍不够完善。需要在D装置的后面连接下图装置,目的是________________,否则测得n值会________(“偏大”、“偏小”、“无影响”) 。
(方案二)
称量100g碳酸镁晶须放入如下图所示的广口瓶中,加入水,滴入稀硫酸与晶须反应,生成的CO2被过量NaOH溶液吸收,在室温下反应4~5h,反应后期将温度升到30℃,最后,烧杯中的溶液加入已知浓度的盐酸恰好完全反应,测得CO2的总量;重复上述操作2次。
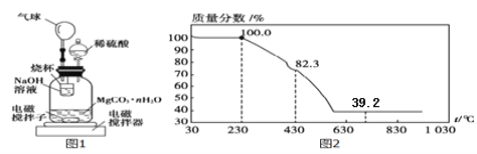
(10)氢氧化钠吸收二氧化碳的化学反应方程式____________________;
(11)图中气球的作用是__________________;
(12)上述反应后期要升温到30℃,主要目的是______________;
(13)设3次实验测得每100 g碳酸镁晶须与稀硫酸反应产生的CO2平均值为ag,则n值为_______(用含a的代数式表示);
(14)称取100g上述晶须产品进行热重分析,热重曲线如图2,则该条件下合成的晶须中,n=_______(写出过程)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碘被公认为人类的“智慧元素”,如图是元素周期表中关于碘元素的信息。下列关于碘元素的说法错误的是
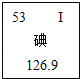
A.碘元素是非金属元素 B.相对原子质量为126.9g
C.原子核内质子数为53 D.原子序数为53
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】二氧化硫是造成酸雨的主要气体,其溶于水形成的水溶液叫亚硫酸(H2SO3)。硫化氢(H2S)是一种具有臭鸡蛋气味的剧毒气体,其水溶液叫氢硫酸。已知相同的条件下,氢硫酸的酸性弱于亚硫酸。室温下向饱和的亚硫酸溶液中通入过量的硫化氢气体,反应的化学方程式为:2H2S+H2SO3 ===3S↓+3H2O。下列亚硫酸溶液的pH随通入的硫化氢体积变化曲线示意图中,正确的是
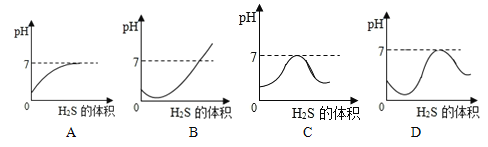
A. A B. B C. C D. D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙三种物质的溶解度曲线如右图所示,据图回答:
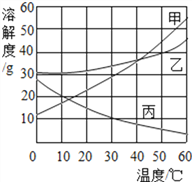
(1)30 ℃时,三种物质的溶解度由大到小的顺序为____________;
(2)要使接近饱和的丙物质溶液变为饱和,可采取的一种措施是________________;
(3)50 ℃时,将等质量的甲、乙、丙三种物质的饱和溶液同时降温至10 ℃时,析出晶体最多的是________,所得溶液中溶质质量分数最大的是_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(题文)小彬同学新买了水龙头,从说明书上了解到该水龙头是铜质镀铬的。他想起在 学习金属化学性质时用到的金属活动性顺序中没有铬,为了了解铬与常见金属铝、铜在金属活动性顺序中的相对位置关系,进行如下探究活动。
(查阅资料)
①铬(Cr)是银白色有光泽的金属,在空气中表面能生成抗腐蚀性的致密氧化膜。
②铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液……
(预测)三种金属在金属活动性顺序中的相对位置关系:
①Cr Al Cu ②Al Cr Cu ③Al Cu Cr
(实验过程)取大小相同的三种金属片,用砂纸打磨光亮。
实验一 | 实验二 | 实验三 | |
实 验 方案 |
|
|
|
实 验现象 | ______________ | ____________ | _______ |
结论 | 铬 与 稀 硫 酸 可 以 反应,速度较慢 | 铜不与稀硫酸反应 | _____ |
三种金属在金属活动性顺序表中的相对位置关系是_____ | |||
(回答问题)
(1)将上表中三处划横线的位置填上适当的内容。
(2)用砂纸打磨金属片的目的是_____。
(3)实验一所发生反应的化学方程式是_____。
(4)小东提出用硫酸铝溶液代替上述实验中的稀硫酸,小燕认为不可行,理由是_____。
(5)上述实验用了四种药品,小清认为只要选用三种药品进行实验就可以得出三种金属在 金属活动性顺序表中的相对位置关系,这三种药品可以是_____。
(6)实验发现,相等浓度的盐酸和硫酸,盐酸和铝反应的速率比硫酸快得多,可能的原因是:_____,请设计实验证明你的猜想____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具。下图是元素周期表的一部分。
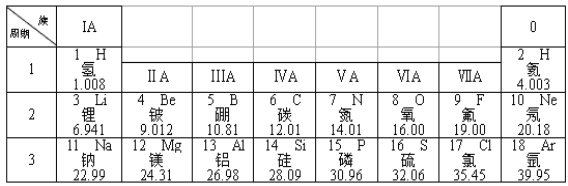
(1)从表中查出硫(S)元素的相对原子质量为_______;
(2)6~12号元素中属于金属元素的有____________种;
(3)表中不同种元素最本质的区别是______(填字母):
A.质子数不同 B.中子数不同 C.相对原子质量不同
(4)上述表中和氟化学性质相似的是__________(填元素符号);
(5)科学家宣布已人工合成了第116号元素,则此元素的核电荷数为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】NH4Cl和Na2SO4的溶解度表及溶解度曲线如图.下列说法错误的是( )

温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度S/g | NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 60.2 |
Na2SO4 | 9.6 | 20.2 | 40.8 | 48.4 | 47.5 | 47.0 | |
A. 乙为NH4Cl
B. t3应介于40℃﹣50℃
C. 55℃时,分别将两饱和溶液蒸发等质量的水,得到固体质量甲>乙
D. 等质量的甲、乙饱和溶液从t3降温到t1,析出的晶体质量相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com