
【题目】人类生产、生活离不开化学,用所学的知识填空。
(1)空气中O2所占的体积分数约为____。
(2)硬水是指含有较多可溶性___化合物的水。
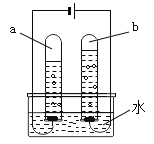
(3)如图所示为电解水的实验,该实验证明水是由__组成的,若试管b中产生气体体积为6 mL,则试管a中产生气体体积为___mL,该反应的化学方程式是___。分解高氯酸钾(KClO4)也可制得氧气,高氯酸钾中氯元素的化合价是___。
(4)过滤器中的活性炭可除去有气味的物质,这是利用了活性炭的____性。
【答案】21% 钙、镁离子 氢、氧两种元素 12 2H2O![]() 2H2↑+O2↑ +7 吸附
2H2↑+O2↑ +7 吸附
【解析】
(1)空气中O2所占的体积分数约为21%。
(2)硬水是指含有较多可溶性钙、镁离子化合物的水。软水是指含有少量(或不含)可溶性钙、镁离子化合物的水。
(3)如图所示为电解水的实验,水通电产生氢气和氧气,该实验证明水是由氢、氧两种元素组成的,试管b连接电源正极,产生氧气,产生氧气的体积为6 mL,则试管a中产生气体体积为12mL,水通电产生氢气和氧气的化学方程式是2H2O![]() 2H2↑+O2↑。分解高氯酸钾(KClO4)也可制得氧气,
2H2↑+O2↑。分解高氯酸钾(KClO4)也可制得氧气,
解:设高氯酸钾中氯元素的化合价是x,则(+1)+x+(-2)×4=0,x=+7;
(4)过滤器中的活性炭可除去有气味的物质,活性炭具有疏松多孔状结构,这是利用了活性炭的吸附性。


科目:初中化学 来源: 题型:
【题目】甲、乙两位同学分别利用下图装置研究可燃物的燃烧条件。
已知:白磷的着火点为40℃,红磷的着火点为240℃。
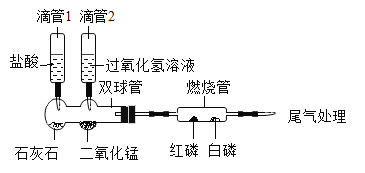
甲同学:挤压滴管1,一段时间后,加热燃烧管至260℃以上,白磷和红磷均不燃烧。
乙同学:微热燃烧管至60℃,一段时间后,挤压滴管2,观察现象并完成下列各题。
(1)甲同学挤压滴管1后有二氧化碳生成,请写出该反应的化学方程式:_____。
(2)得出可燃物燃烧需要温度达到着火点的结论,对应的现象是____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】电解法是工业炼铜的主要方法,化学方程式为2CuSO4+2H2O![]() 2Cu↓+O2↑+2H2SO4,取一定质量的硫酸铜溶液,在实验室中模拟工业条件进行电解,当硫酸铜恰好完全反应时,得到488.0g溶液和9.6g铜(注:本题不考虑气体在溶液中的溶解)。向电解后得到的488.0g溶液中加入一定量的某物质,充分反应后,所得溶液的质量,溶质量分数均与原硫酸铜溶液相同,则这种物质可能是下列物质中的
2Cu↓+O2↑+2H2SO4,取一定质量的硫酸铜溶液,在实验室中模拟工业条件进行电解,当硫酸铜恰好完全反应时,得到488.0g溶液和9.6g铜(注:本题不考虑气体在溶液中的溶解)。向电解后得到的488.0g溶液中加入一定量的某物质,充分反应后,所得溶液的质量,溶质量分数均与原硫酸铜溶液相同,则这种物质可能是下列物质中的
①Cu ②CuO ③CuCO3 ④Cu(OH)2
A.①②B.②③C.②④D.③④
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】以绿矾(FeSO47H2O)为原料制备高铁酸钾(K2FeO4)的流程如下:
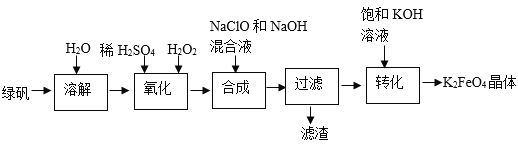
(1)“氧化”是将FeSO4,转化为Fe2(SO4)3,该反应的化学方程式为__。
(2)“合成”时发生的反应为Fe2(SO4)3+3NaClO+10NaOH=2Na2FeO4+3NaCl+3X+5H2O,X的化学式为____。
(3)不同温度和pH下FeO42-在水溶液中的稳定性如图所示。
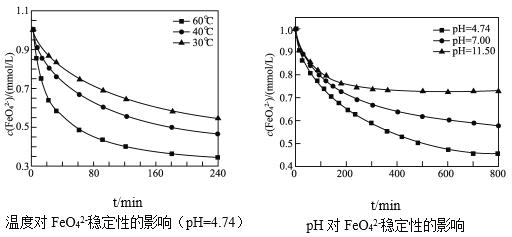
图中纵坐标表示单位体积内FeO42-离子数目的多少,数值越小,表明FeO42-离子数目越少,在该条件下越不稳定。为了提高“合成”时Na2FeO4的产率,下列措施可行的是____
A 充分搅拌反应液
B 控制反应在60℃左右进行
C 控制反应在碱性条件下进行
(4)“滤渣”呈红褐色,推测其主要成分为____(填化学式)。
(5)常温下向“过滤”后的滤液中加入饱和KOH溶液,即可析出K2FeO4晶体,由以上信息可知K2FeO4的溶解度比Na2FeO4的溶解度_______(填“大”或“小”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】《鲁滨逊漂流记》中的主人公在荒岛采用下图方法将海水淡化。
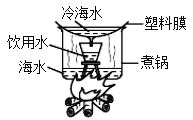
(1)海水经蒸发、冷凝变为饮用水,发生了_____________ (填“物理”或“化学”)变化。
(2)从微观角度分析上述过程,下列说法正确的是_____________(填序号)。
A 蒸发时水分子体积变大
B 冷凝时水分子质量减小
C 蒸发时水分子运动速率加快
D 冷凝时水分子间隔减小
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下列装置图回答问题:
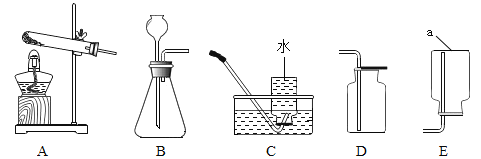
(1)写出仪器a的名称:_____。
(2)实验室用氯酸钾和二氧化锰制氧气,该反应的化学方程式为_________。反应中二氧化锰所起的作用为__作用。
(3)实验室用石灰石和稀盐酸反应制取并收集二氧化碳,应选用的装置为___(填字母序号),该反应的化学方程式为____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室欲测定一瓶标签破损的稀硫酸的溶质质量分数。现取10g稀硫酸样品,将5%的NaOH溶液逐滴加入到样品中,边加边搅拌,随着NaOH溶液加入,溶液的pH的变化如下图所示。试回答:
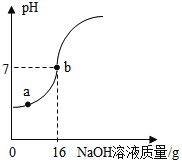
(1)b点表示____________________。
(2)当pH=7时,消耗_______________gNaOH溶液,其溶质NaOH的质量为______g。
(3)计算10g稀硫酸中溶质的质量_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图,碳化铝(又叫三碳化四铝)是黄色或绿灰色粉末,常用于冶金。以下框图表示的是与碳化铝有关的制备和性质的反应。


已知:G属于碱类,B属于金属单质,E在常温下为液体,F的相对分子质量小于24,试根据框图回答:
(1)E的化学式______,G的化学式______;
(2)①反应的化学方程式______;
(3)③反应的化学方程式______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属是一种重要的资源,人类的生产、生活与金属密切相关。
(1)铁制品锈蚀的过程,实际上是铁与空气中的氧气、__等发生化学反应的过程。
(2)常温下大多数金属都可以锻压成薄片或拉伸成细丝,这说明大多数金属具有__性。
(3)铁和氧气在不同的条件下能发生不同的反应。如灼热的铁丝在氧气中发生燃烧,反应的化学方程式是__。
(4)常温储氢材料用于吸收和释放氢气。某镁铝储氢合金材料的化学组成为Mg17Al12,完全吸收氢气后得到MgH2和Al。该反应的化学方程式为__。
(5)第四套人民币硬币铸造使用了Fe、Cu、Al、Ni(镍)四种金属。已知Ni能够在溶液中发生如下反应:Ni+H2SO4 ═ NiSO4+H2↑、Fe+NiCl2═Ni+FeCl2。上述两个反应的基本反应类型是__;Fe、Cu、Al、Ni(镍)四种金属的活动性由强到弱的顺序为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com