
【题目】五氧化二钒(V2O5)是一种工业催化剂,下图是生产V2O5的工业流程,下列说法正确的是
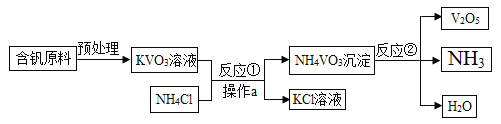
A. NH3能使干燥的红色石蕊试纸变蓝
B. 反应①中生成的副产物KCl在农业上可用作钾肥
C. 反应②的化学方程式为2NH4VO3![]() V2O5+2NH3↑+H2O
V2O5+2NH3↑+H2O
D. 操作a中需要的所有仪器为铁架台、烧杯、滤纸、玻璃棒
 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
【题目】人类生活生产离不开金属,请回答下列问题:
(1)下列现象和事实,不.可.以.用金属活动性作合理解释的是__________。
A.金属镁在空气中比铝更容易燃烧, 说明镁比铝的活动性强
B.金属铝比金属锌更耐腐蚀, 说明锌比铝活动性强
C.用硫酸铜、生石灰加水配制农药波尔多液时,不能用铁制容器
D.金属的种类很多,但在自然界中,仅有少数金属如金、银等有单质形式存在
(2)某小组用如下图所示装置对铁生锈的条件进行探究,四分钟后发现 A 中铁钉表面灰暗,B 中铁钉依然光亮,对比 A、B 现象说明:决定铁生锈快慢的一个重要因素是____。
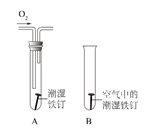
(3)多数金属以矿物形式存在于自然界,金属矿物可以用来冶炼金属。
①高炉炼铁的原料主要是铁矿石、______、石灰石、空气。工业上常用赤铁矿(主要成分是Fe2O3)在高炉中炼铁,反应的化学方程式是___________ 。
②我国古代将炉甘石(ZnCO3)、赤铜(Cu2O)和木炭粉混合后加热到 800℃, 得到貌似金 子的铜锌合金,反应原理如下,试补充完成其中的另外两个化学方程式。
A.ZnCO3=ZnO+CO2↑
B.C+2Cu2O=_____________+CO2↑
C.____________________
(4)将mgZn和Fe的混合物中加入一定质量的CuCl2,充分反应后过滤,将滤渣洗涤, 干燥后称量质量仍为 mg,对所得滤液和滤渣的判断不正确的是_____________。
A.滤液中一定有ZnCl2和FeCl2 B.滤液为无色
C.滤渣中只有铜 D.滤渣中加稀盐酸一定有气泡产生
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】通过化学反应,可以生产出自然界不存在的新材料新物质:
(1)利用赤铁矿和焦炭等在高炉可冶炼出生铁,反应原理为___________________
(2)因金属锈蚀而报废的金属设施全世界一年总量在3—6亿吨,铁生锈的主要条件是与_____直接接触,预防金属锈蚀就是要破坏生锈的条件,如自行车链条表面_____________可防锈等。
(3)在自然界中,金、银都有以单质形式的存在,铁、铝等都以化合物形式存在,这说明铁、铝等的化学活动性比金、银___________(活泼或不活泼)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】将5%的NaOH溶液逐滴加入10g稀盐酸中,边滴加边搅拌,随着NaOH溶液的加入,溶液pH的变化如图所示,请回答:
(1)当恰好完全反应时,消耗NaOH溶液的质量为多少g;
(2)计算稀盐酸中溶质的质量分数。
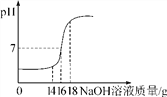
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】五氧化二钒(V2O5)是一种工业催化剂,下图是生产V2O5的工业流程,下列说法正确的是
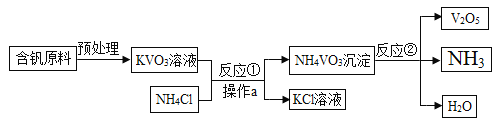
A. NH3能使干燥的红色石蕊试纸变蓝
B. 反应①中生成的副产物KCl在农业上可用作钾肥
C. 反应②的化学方程式为2NH4VO3![]() V2O5+2NH3↑+H2O
V2O5+2NH3↑+H2O
D. 操作a中需要的所有仪器为铁架台、烧杯、滤纸、玻璃棒
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国早期纯碱生产的工艺流程可简要表示如下,下列说法正确的是
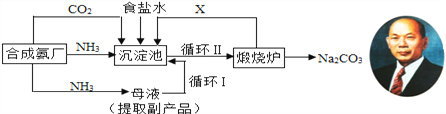
A. 沉淀池中发生的化学反应方程式是NaCl + H2O + NH3 + CO2 == NaHCO3↓+ NH4Cl
B. 副产品氯化铵与熟石灰混合使用可提高肥效
C. 实验中要向食盐水中先通入CO2再通入NH3
D. CO2和NH3等物质循环使用,降低生产成本
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小明选择“铝丝和盐酸反应的快慢与什么因素有关”的课题开展探究。下表是他分别用相同质量的铝丝和足量稀盐酸反应的三组实验数据:
实验编号 | 盐酸的浓度/% | 反应温度/℃ | 铝丝消失 的时间/s |
① | 3 | 20 | 500 |
② | 6 | 20 | 300 |
③ | 6 | 30 | 80 |
(1)写出铝和盐酸反应的化学方程式:________________________________。
(2)实验②和③表明:该反应的快慢与__________有关。
(3)能表明盐酸浓度对反应快慢有影响的实验编号是________和________。
(4)如果把实验①中盐酸的浓度改为4%,请你推出铝丝消失的时间(用t表示)的取值范围:________________。
(5)该实验除了用铝丝消失的时间来衡量反应的快慢外,你还能提出新的方法来衡量该反应的快慢吗?
方法:_____________________________________________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学配制60 g溶质质量分数为5%的NaCl溶液,准备了下列实验用品。回答下列问题:
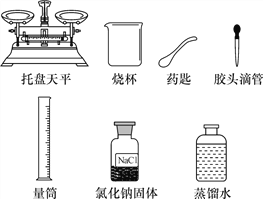
(1)该同学按下列实验步骤进行:①计算,②称量,③量取,④________(填步骤名称);⑤装瓶。
(2)配制过程还缺少的一种玻璃仪器是__________(填名称)。
(3)计算所需NaCl的质量为______g,称量时,NaCl应放在托盘天平的______(选填“左盘”或“右盘”)上。
(4)量取蒸馏水操作如下:将蒸馏水注入量筒,待液面接近量取体积对应刻度线时,改用________(填仪器名称)滴加蒸馏水至刻度线。下图该同学观察方式正确的是________(填序号)
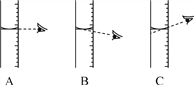
(5)若用C观察方式量取水的体积,所配制溶液的溶质质量分数会________(选填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验小组探究盐酸和氢氧化钠反应过程中溶液pH的变化规律,得到如图所示曲线.下列有关该实验事实的说法正确的是( )
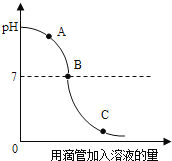
A.该实验是将氢氧化钠溶液滴入盐酸中
B.B点表示盐酸和氢氧化钠恰好完全反应
C.A点时的溶液能使酚酞试液变红
D.C点时,溶液中的溶质只有氯化钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com