5.
小明记得在学习金属活动性顺序的应用时,老师曾说过一般不会用K、Ca、Na等活泼金属和盐溶液进行置换反应,因为这些金属能直接和水发生反应生成对应的碱和氢气.小明查阅资料如下:
【资料卡片】:
(1)Na和冷水剧烈反应,2Na+2H
2O═2NaOH+H
2↑;
(2)镁和冷水反应缓慢,和沸水反应剧烈,Mg+2H
2O═Mg(OH)
2+H
2↑;
(3)Al和沸水反应非常缓慢,2Al+6H
2O═2Al(OH)
3+3H
2↑;
Ⅰ、从上述资料中,你能得出金属和水反应的条件和产物有何不同和相似之处?
(1)相同点:都生成碱和氢气;
(2)不同点:反应的剧烈程度不同.
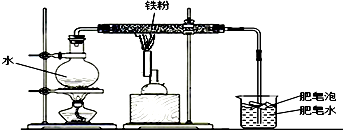
Ⅱ、小明对此非常好奇,在老师的帮助下,查阅了相关资料并做了铁粉在高温条件下和水蒸气的反应,装置如下图所示:
【资料卡片】:
A、铁的氧化物的热稳定性顺序是FeO(黑色)>Fe
3O
4>Fe
2O
3,且Fe
3O
4有磁性;
B、Fe
2O
3分解温度在1400℃以上,Fe
3O
4分解温度在1538℃以上;
C、Fe(OH)
2是一种白色固体,在空气很快变成灰绿色,最终变为红褐色.
实验进行2分钟后,用燃着的木条点燃肥皂泡,可以观察到一团火焰.同时发现玻璃管内灰黑色物质先红热,最终变成黑色晶体,整个实验持续10分钟左右.
(1)你认为该反应为什么要在高温下才能进行?保证了四氧化三铁、氧化铁的分解;
(2)火焰的产生,说明该反应生成了氢气,在点燃该气体前,一定要检验纯度;
(3)实验结束后,所进行的实验操作应该是先撤导管,后熄灭酒精灯.这样做的目的是防止水槽中水倒流,炸裂试管.
Ⅲ、通过Ⅱ中的实验现象,大家对反应后玻璃管中残留的黑色物质的成分猜想如下:
1:Fe(OH)
3;2:Fe(OH)
2;3:FeO;4:Fe
2O
3;5:Fe
3O
4;6:Fe.(可多填)
甲同学认为:猜想1、2、4明显错误,理由是氢氧化铁、氢氧化亚铁、氧化铁热稳定性差;
对于其他猜想,同学们又做了如下实验:
| 实验方案 | 实验现象 |
| 甲 | 将磁铁靠近黑色粉末 | 黑色粉末可被磁铁全部吸引 |
| 乙 | 取少量黑色粉末加入稀盐酸中 | 有气泡 |
甲同学根据实验现象,认为此黑色物质是Fe
3O
4,但对于他的结论,乙同学认为不妥,他的理由是铁也能被磁铁吸引;
根据甲、乙两同学的实验,还可以排除猜想3、5,理由是氧化亚铁、四氧化三铁不会与稀盐酸反应生成气体;
为进一步确认此黑色物质,同学们再次进行了实验:
| 实验方案 | 实验现象 | 结论或化学方程式 |
| 1、取实验后的黑色粉末,加入足量的A溶液,搅拌使反应充分. | 黑色物质表面有红色物质,溶液颜色出现较浅的绿色,烧杯底部仍有较多黑色物质 | Fe+CuSO4=FeSO4+Cu |
| 2、过滤、洗涤、干燥,再用磁铁吸引 | 黑色物质可被磁铁全部吸引,留下红色固体 | 被磁铁吸引的物质是铁 |
结合资料综合分析,回答下列问题:
(1)玻璃管中残留的黑色物质应为碳,铁粉和水蒸气在高温下反应的化学方程式为:3Fe+4H
2O$\frac{\underline{\;高温\;}}{\;}$Fe
3O
4+4H
2,属于置换反应;
(2)实验1中的A溶液为硫酸铜溶液,加A溶液的目的是验证黑色物质中含有铁.
Ⅳ、丙同学用定量的方法确定实验后玻璃管中黑色物质的组成.方案如下:
将5.6gFe粉和足量的H
2O(气)充分反应后,得到7.2g黑色固体,再将此黑色固体加入150g足量稀盐酸中继续反应,充分反应后,称得烧杯内溶液质量为157.15g.请根据上述数据计算出7.2g黑色物质的组成,确证上述探究结论.(写出计算过程)
Ⅴ、反思评价:
(1)该氧化物又可以经过此反应的逆反应生成颗粒很细的铁粉.这种铁粉具有很高的反应活性,在空气中受撞击或加热时会燃烧,所以俗称“引火铁”.写出此反应的化学方程式:
Fe
3O
4+4H
2$\frac{\underline{\;高温\;}}{\;}$3Fe+4H
2O;
(2)砖窑用粘土烧制青砖(颜色发黑的砖)时,窑内温度可达1150℃,Fe
2O
3和H
2反应生成FeO,写出该反应的化学方程式Fe
2O
3+H
2$\frac{\underline{\;1150℃\;}}{\;}$2FeO+H
2O.

 小明记得在学习金属活动性顺序的应用时,老师曾说过一般不会用K、Ca、Na等活泼金属和盐溶液进行置换反应,因为这些金属能直接和水发生反应生成对应的碱和氢气.小明查阅资料如下:
小明记得在学习金属活动性顺序的应用时,老师曾说过一般不会用K、Ca、Na等活泼金属和盐溶液进行置换反应,因为这些金属能直接和水发生反应生成对应的碱和氢气.小明查阅资料如下: