
20 g 20%的NaOH溶液与20 g 20%的H2SO4溶液充分反应后,滴入紫色石蕊溶液显( )。
A.蓝色 B.紫色 C.红色 D.无色
科目:初中化学 来源: 题型:阅读理解
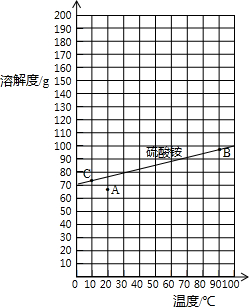
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 溶解度/g | 70.6 | 73 | 75.4 | 78 | 81 | 85 | 88 | ? | 95 | 98 | 103 |
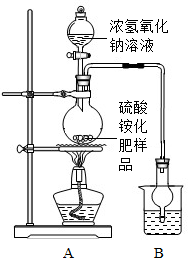
| 指标项目 | 优等品 | 一等品 | 合格品 |
| 外观 | 白色结晶,无可见机械杂质 | 无可见机械杂质 | |
| 氮(N)含量 | ≥21.0% | ≥20.7% | ≥20.5% |
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
| 第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
| 加入稀盐酸的总质量(g) | 10 | 20 | 30 | 40 | 50 |
| 烧杯和药品总质量(g) | 25.56 | 35.12 | 44.68 | 54.24 | 64.24 |
查看答案和解析>>
科目:初中化学 来源: 题型:
硝酸铵是农业生产中常用的化学肥料。为测定某含有少量NaNO3的硝酸铵样品中NH4NO3的纯度,取 2.0 g 该硝酸铵样品于容器中,滴入5.0g 20%的NaOH溶液。发生如下反应:NH4NO3+NaOH=NaNO3+NH3↑+H2O。反应过程中放出的氨气质量及加入的NaOH溶液的质量的关系如图所示:完成有关计算:
(1)NH4NO3中各元素的质量比为(H:N:O) ;
(2)样品中硝酸铵的质量分数;
(3)所得溶液中NaNO3的质量分数(保留两位小数)。
查看答案和解析>>
科目:初中化学 来源:2009年全国中考化学试题分类汇编考点21 溶质质量分数(带解析) 题型:计算题
硝酸铵是农业生产中常用的化学肥料。为测定某含有少量NaNO3的硝酸铵样品中NH4NO3的纯度,取 2.0 g 该硝酸铵样品于容器中,滴入5.0g 20%的NaOH溶液。发生如下反应:NH4NO3+NaOH=NaNO3+NH3↑+H2O。反应 过程中放出的氨气质量及加入的NaOH溶液的质量的关系如图所示:完成有关计算:
过程中放出的氨气质量及加入的NaOH溶液的质量的关系如图所示:完成有关计算: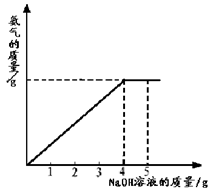
(1)NH4NO3中各元素的质量比为(H:N:O) ;
(2)样品中硝酸铵的质量分数;
(3)所得溶液中NaNO3的质量分数(保留两位小数)。
查看答案和解析>>
科目:初中化学 来源: 题型:
硝酸铵是农业生产中常用的化学肥料。为测定某含有少量NaNO3的硝酸铵样品中NH4NO3的纯度,取2.0 g该硝酸铵样品于容器中,滴入5.0 g 20%的NaOH溶液。发生如下反应:NH4NO3+NaOH===NaNO3+NH3↑+H2O。反应过程中放出的氨气质量及加入的NaOH溶液的质量的关系如图所示:
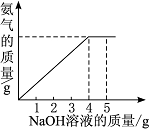
完成有关计算:
(1)NH4NO3中各元素的质量比为[m(H)∶m(N)∶m(O)]__________。
(2)样品中硝酸铵的质量分数。
(3)所得溶液中NaNO3的质量分数(保留两位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com