
| A. | CaCl2,Ca(NO3)2,Na2CO3 | B. | MgSO4,Fe(OH)3,Ba(OH)2 | ||
| C. | Cu(NO3)2,HCl,NaOH | D. | Ag,Al,CuSO4 |
科目:初中化学 来源: 题型:多选题
| A. | 1:4 | B. | 1:5 | C. | 1:8 | D. | 1:9 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| NaHCO3 | Na2CO3 | |
| 加入稀盐酸 | 产生气泡 | 产生气泡 |
| 加入CaCl2溶液 | 无明显现象 | 溶液变浑浊 |
| 实验步骤 | 实验现象 | |
| ①取少量样品溶于水,加入过量的氯化钙溶液. | 有白色沉淀产生 | 该反应的方程式: Na2CO3+CaCl2═CaCO3↓+2NaCl |
| ②将上述反应后的混合液过滤,取滤液滴加稀盐酸 | 有气泡冒出 | 该反应的方程式: Na2CO3+2HCl═2NaCl+H2O+CO2↑ 证明猜想②成立. |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
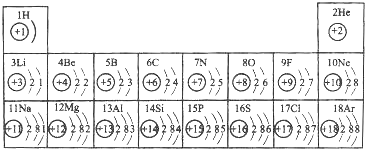
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
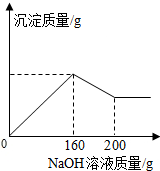 已知氢氧化铝能溶解在过量的氢氧化钠溶液中生成偏铝酸钠(NaAlO2)溶液,有关化学方程式为:Al(OH)3+NaOH═NaAlO2+2H2O.现有160.0g某无色溶液,可能含有稀硫酸、硫酸镁、硝酸钾、硫酸亚铁、氯化铝、碳酸钾中的一种或数种.取100.0g该溶液于烧杯中,往其中逐滴加入20.0%的NaOH溶液,产生沉淀的质量与加入NaOH溶液的质量关系如图所示.下列有关的判断正确的个数是( )
已知氢氧化铝能溶解在过量的氢氧化钠溶液中生成偏铝酸钠(NaAlO2)溶液,有关化学方程式为:Al(OH)3+NaOH═NaAlO2+2H2O.现有160.0g某无色溶液,可能含有稀硫酸、硫酸镁、硝酸钾、硫酸亚铁、氯化铝、碳酸钾中的一种或数种.取100.0g该溶液于烧杯中,往其中逐滴加入20.0%的NaOH溶液,产生沉淀的质量与加入NaOH溶液的质量关系如图所示.下列有关的判断正确的个数是( )| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 磷在氧气中燃烧,产生大量白雾 | B. | 木炭在空气中燃烧发出白光 | ||
| C. | 铁丝在氧气中燃烧火焰呈蓝色 | D. | 硫在氧气中燃烧发出蓝紫色火焰 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com