
【题目】辩证中认识物质:含碳元素的可燃物不完全燃烧会生成一氧化碳气体。一氧化碳无色、无气味有剧毒,难溶于水,能燃烧。
(1)一氧化碳的物理性质有___(写一条)。
(2)一氧化碳燃烧的化学反应方程式_______。
(3)下列方法可以减少一氧化碳污染的是________(填标号)。
A 烧炭取暖时在房间里放一盆水 B 将煤球制成蜂窝煤
C 焚烧秸秆 D 使用共享单车绿色出行
 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
【题目】现有一包黑色固体粉末,可能含有炭粉、氧化铜、四氧化三铁中的两种或者三种,某化学兴趣小组通过实验探究其成分。
(提出问题):该黑色固体粉末成分是什么?
(作出猜想):
猜想一:混合固体是炭粉、氧化铜 猜想二:混合固体是炭粉、四氧化三铁
猜想三:混合固体是氧化铜、 四氧化三铁 猜想四:混合固体是______
(查阅资料):
①Fe3O4能与盐酸反应
②含有Fe3+的盐溶液遇到KSCN(硫氰化钾)溶液时变成红色
③Fe(OH)2是一种白色沉淀,化学性质不稳定,最终转化为红褐色沉淀
(定性探究):
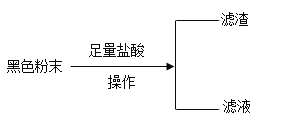
(1)在“操作”中需要用的玻璃仪器有:烧杯、玻璃棒、_____,玻璃棒的作用为_____,所得滤渣为______(填化学式);
(2)取滤液进行如下探究:(表格内填化学式)
实验操作 | 实验现象 | 实验结论 |
步骤一:取一定量的滤液于试管中,加入足量的铁粉 | 无红色固体析出 | 该固体中一定没有____ |
步骤二:又取一定量的滤液于试管中,加入少量的KSCN(硫氰化钾)溶液 | 溶液变成红色 | 滤液中一定含有的物质是______ |
步骤三:再取一定量的滤液于试管中,加入足量的NaOH溶液 | 有红褐色沉淀生成,同时还有少量的白色沉淀生成,白色沉淀迅速变成灰绿色,最终全部变成红褐色 | 滤液中还一定含有的物质是___ |
(讨论交流):
(1)步骤三中滤液里加入氢氧化钠溶液产生红褐色沉淀化学方程式是_____;
(2)通过以上实验,猜想 ________成立;
(3)Fe3O4与盐酸反应时元素的化合价没有改变,请大家推断Fe3O4中铁元素的化合价为____、____;
(4)现取该黑色粉末,经过以下操作,将该粉末中的铁元素全部转化为铁单质:步骤:_____。
(定量分析):
该化学兴趣小组取5g该黑色粉末,加入足量的盐酸后得到0.6g滤渣,则该黑色粉中的其他元素的质量分别是____?(写出计算过程,结果保留一位小数)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】将颗粒大小相同的等质量X、Y、Z三种金属放入等浓度的稀盐酸中,产生氢气质量如图所示,下列说法正确的是
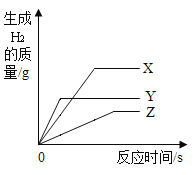
A.金属X最活泼
B.金属Y的相对原子质量一定大于X
C.若金属Z是Fe,则金属X一定不是Al
D.金属Z反应掉的稀盐酸一定最少
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在目前全民抗击“新冠肺炎”的疫情中,人们采取的防护措施有很多,其中之一是通过涂抹浓度为75%的医用酒精溶液进行消毒,下列有关说法正确的是
A.酒精是由9个原子构成的
B.酒精中C、H、O 三种元素的质量比为2:6:1
C.酒精属于有机混合物
D.酒精的相对分子质量为46
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】以下是初中化学的一些基本实验装置,请根据实验内容
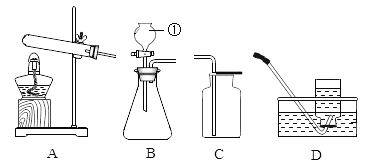
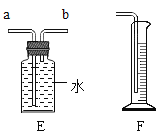
回答下列问题.
(1)写出标号①的仪器名称_____。
(2)实验室用氯酸钾和二氧化锰制取并收集较纯净的氧气时,应选用的是___(填字母),写出该反应的化学方程式____。
(3)将下面E和F装置连接,可以测量氧气的体积,氧气应从_____(填“a”或“b”)口通入。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】阅读下面的科普材料。
2019年度诺贝尔化学奖被授予约翰·古迪纳夫、斯坦利·惠廷厄姆和吉野彰三位科学家,以表彰其在锂离子电池的发展方面作出的贡献,奠定了无线电子产品的基础,给予我们进入无化石燃料世界的可能性,因为它能用于各种事物,从给电动汽车供电到从可再生能源中储存能量。
新能源汽车按照电池种类的不同可以分为镍氢电池动力汽车、锂电池动力汽车和燃料电池动力汽车。镍氢电池具有大功率、快速充放电等优点,但也有成本高,自放电程度大等不足,锂电池在整个充放电过程中,锂离子往返于正负极之间实现能量的转化。锂电池月自放电率仅为6%~8%,远低于镍氢电池。由于正极材料LiCoO2的价格高,目前是市场上高端电动汽车的主要动力源。质子交换膜燃料电池是燃料电池中的一种,其工作原理是在催化剂的作用下,氢气、氧气分别在各自电极发生电离后生成水,并释放出能量。由于质子交换膜燃料电池以铂族贵金属作电催化剂,燃料净化程度要求高,并且只能用热水回收余热,所以并未广泛应用。
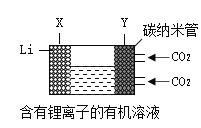
(1)化石燃料是_____能源(填“可再生”或“非可再生”)。
(2)质子交换膜燃料电池可实现零排放,该反应的化学方程式是_____,能量转化形式为_____
(3)现有一种锂离子二次电池,其工作原理如图。放电时生成的Li2CO3固体和碳储存于碳纳米管中。放电时,电池的总反应为_____。
(4)下列说法中正确的是_____
A镍氢电池汽车具有大功率、快速充放电等优点
B锂电池月自放电率高,远高于镍氢电池
C电池属于无害垃圾,可以随意丟弃
D质子交换膜燃料电池电源是一种清洁的绿色环保电源
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】抗击“新型冠状病毒”用到的过氧乙酸(C2H4O3)是一种高效消毒剂。可由冰醋酸(C2H4O2)和双氧水在浓硫酸催化作用下制得,实验装置和步骤如下:
步骤1:在三颈烧瓶中加入一定量冰醋酸与浓硫酸的混合物,再缓缓加入适量30%的双氧水;步骤2:不断搅拌并控制三颈烧瓶中混合液的温度为20~30℃至反应结束,在锥形瓶中收集产品。
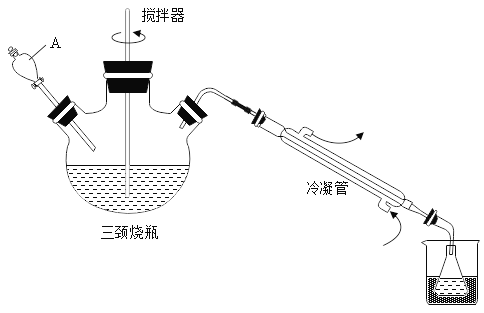
(1)仪器A的名称是_____
(2)步骤2搅拌的目的是_____
(3)下列关于过氧乙酸和冰酷酸的说法正确的是_____
a、过氧乙酸属于氧化物
b、过氧乙酸的相对分子质量为76
c、冰醋酸中C、H、O元素的质量比为6:1:8
d、过氧乙酸中氧元素的质量分数小于冰醋酸中氧元素的质量分数
(4)实验测得生成物过氧乙酸的质量分数随反应物比例![]() 和反应时间的变化数据如下表。由表中数据可知,反应物最佳比例是_____;最佳反应时间约_____。
和反应时间的变化数据如下表。由表中数据可知,反应物最佳比例是_____;最佳反应时间约_____。
反应物比例 | 反应时间 | |||||
0.5h | 1h | 3h | 5h | 7h | ||
2:1 | 7.38% | 8.46% | 9.42% | 11.26% | 13.48% | |
1:1 | 10.56% | 12.92% | 13.54% | 20.72% | 20.80% | |
1:2 | 6.14% | 7.10% | 7.96% | 10.38% | 12.36% | |
(5)产品中过氧乙酸的质量分数的测定方法如下:取5.00g过氧乙酸产品,加水稀释成100g溶液;从取出5.00g溶液,先除去残余的H2O2,再加入稍过量的KI溶液,充分发生反应:C2H4O3+2KI+H2SO4=K2SO4+I2+C2H4O2+H2O,反应结束后,经实验测得生成I2的质量为0.127g,试计算原产品中过氧乙酸的质量分数。_____(写出计算过程,结果保留1位小数)。
(6)请根据你学过的“一定溶质质量分数溶液的配制”方法配制0.5%的过氧乙酸,用于地面、墙壁、门窗的消毒。
(实验用品)溶质质量分数为20%的过氧乙酸(密度为1.0261g/cm3)、水、1000mL量筒、10L塑料桶、木棒、口罩、眼镜、橡皮手套。
(实验步骤)①计算:将200mL20%的过氧乙酸(密度为1.026g/cm3)稀释为0.5%的过氧乙酸,需加入水的体积为_____mL(计算结果保留一位小数);
②配制:用量筒量取200mL20%的过氧乙酸倒入塑料桶中,按比例兑水,用木棒搅拌后,盖好桶盖待用。
(实验反思)
①由于过氧乙酸有腐蚀性,因此在配制溶液时要注意_____;
②在配制过氧乙酸过程中不能用铁器皿,原因是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】湿地之都,水绿盐城!
(1)新四军纪念馆是盐城市的名片之一。馆内有许多抗战时的枪炮,但有些表面出现锈迹,其主要原因是:铁与_______等物质共同作用的结果。稀盐酸可用来除铁锈,化学方程式为_______。
(2)郭猛的温泉度假村是人们休闲的好去处。
①温泉水富含钾、钙、镁、氟、硅等,这里的“钾、钙、镁、氟、硅”指的是_______(填序号)。
A 分子 B 原子 C 元素 D 单质
②温泉水的pH在7.5~8.9之间,若先将pH试纸用蒸馏水润湿,再进行测定,则所测得的结果_______(填“偏大”、“偏小”或“不受影响”)。
(3)自来水的生产过程如图所示。
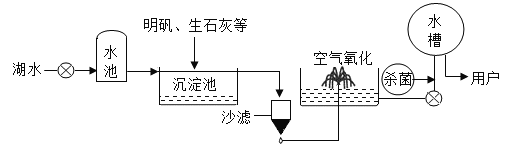
①上述生产过程中使用的净水方法有_______(填序号)。
A 沉淀 B 过滤 C 煮沸 D 蒸馏
②自来水用氯气杀菌消毒。请将下列化学方程式补充完整:Cl2+ H2O = HClO +_______。
③能否用硝酸银区分该厂的自来水和蒸馏水________(填“能”或“不能”)。
(4)清洗餐具上的油污,常在水中加少量洗洁精,洗洁精所起的作用是_______。
(5)配制10%的氯化钠溶液时,会引起溶液中氯化钠质量分数偏大的是_______(填序号)。
A 用量筒量取水时俯视读数 B 配制溶液的烧杯中残留少量蒸馏水
C 氯化钠晶体不纯 D 转移已配好的溶液时,有少量溶液溅出
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在20mL某硫酸铜溶液中,逐滴加入某浓度的氢氧化钡溶液,溶液的pH值随加入的Ba(OH)2溶液体积的变化曲线如图甲所示:
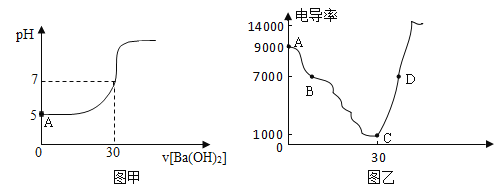
(1)硫酸铜和氢氧化钡溶液发生反应的化学方程式为:_____;实际参加反应的微粒是_____。
(2)图甲中A点所示溶液中,含有的阳离子有_____。
(3)将打磨过的铝片放入上述硫酸铜溶液中,可以观察到的现象是:_____。
(4)某中学学生用电导仪测该实验过程中溶液的电导率(电导率越高表示溶液的导电性越好),如图乙;D点所示溶液能导电是因为溶液中含有的微粒是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com