
【题目】在宏观、微观和符号之间建立联系是化学学科学习的特点。甲、乙、丙、丁表示四种物质,它们的微观示意图如表所示
物质 | 甲 | 乙 | 丙 | 丁 |
|
微观示意图 |
|
|
|
|
(1)一个丙分子共有_____个原子。
(2)甲、乙两种物质在一定条件下反应生成丙和丁,反应的化学方程式为_____参加反应的甲和乙的分子个数比为_____。
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:初中化学 来源: 题型:
【题目】如图是一些粒子的结构示意图,请仔细观察、分析,然后回答下列问题
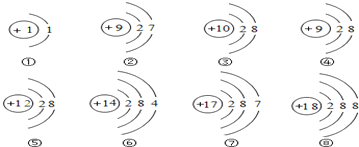
(1)上述粒子中属于同一种元素的是 ______ (填序号),属于阳离子的是 _____(填序号);符号表示为______。
(2)②是____(金属、非金属)元素,在化学变化中容易____(得到、失去)电子,和②化学性质相似的元素是______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在学习盐酸的化学性质时,甲、乙两位同学分别做了稀盐酸和碳酸钠溶液反应的实验(如图1)。
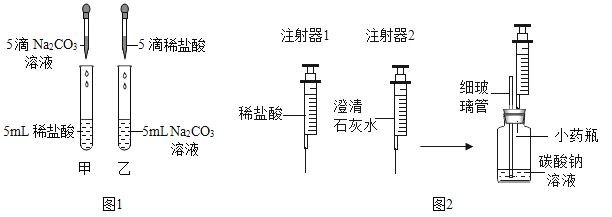
(实验现象)甲同学的实验中溶液有气泡冒出,乙同学的实验中溶液无气泡冒出。
(1)写出甲同学实验的化学反应方程式:_____________。
(提出问题)乙同学的实验中溶液为什么没有气泡冒出?
(查阅资料)碳酸钠和稀盐酸反应不仅可以生成二氧化碳还可以生成碳酸氢钠
(实验)同学们设计并进行了如图2所示的实验(装置气密性良好)。
实验编号 | 实验步骤 | 实验现象 |
① | Ⅰ.用注射器1向小药瓶中缓慢注入少量的稀盐酸,边注入边振荡 | 细玻璃管中液柱略微升高 |
Ⅱ.换注射器2从瓶中缓慢抽取气体 | 澄清石灰水无明显变化 | |
② | Ⅰ.用注射器1向小药瓶中继续注入稀盐酸至较多气泡产生 | |
Ⅱ.换注射器2从瓶中缓慢抽取气体 | 澄清石灰水变浑浊 |
(2)细玻璃管在实验中的主要作用是________;实验①中细玻璃管中液柱略微升高的原因___________。
(3)实验②中Ⅰ的现象是_________;实验①、②中步骤Ⅱ:注射器2必须缓慢地从瓶中抽取气体的原因是_________________。
(实验反思)此反应说明反应物的量不同,产物可能不同,试另举一例:____________。
(若正确回答下列问题加4分,总分不超过60分)
在老师的帮助下,同学们利用pH传感器对相同浓度的碳酸钠溶液(pH为12)、碳酸氢钠溶液(pH为8.2)与稀盐酸反应时,pH的变化与盐酸体积的关系进行了测定,并做了如下所示的对比图:
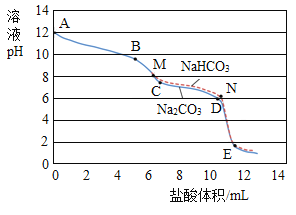
图中各线段实验现象如下表:
溶液 | 线段 | 实验现象 |
Na2CO3 | AB | 无气泡 |
BC | 有少量气泡 | |
CD | 有大量气泡 | |
DE | 几乎无气泡 | |
NaHCO3 | MN | 立即有大量气泡 |
NE | 几乎无气泡 |
(4)在AB段,溶液中的溶质有_________。
(5)分析图表,体现碳酸钠与稀盐酸反应分两步:
第一步反应:Na2CO3+HCl=NaCl+NaHCO3
第二步反应的化学方程式为:__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】鸡蛋壳的主要成分是碳酸钙。为了测定某鸡蛋壳中碳酸钙的质量分数,小军同学进行了如下实验:
将鸡蛋壳洗净、干燥并捣碎后,与足量稀盐酸在烧杯中反应(假设鸡蛋壳中杂质不与稀盐酸反应)。
有关实验数据如表:
反应前 | 反应后 | ||
实验 数据 | 稀盐酸的质量 | 鸡蛋壳的质量 | 剩余物的质量 |
100g | 12g | 108.7g | |
(1)根据质量守恒定律可知,反应中产生二氧化碳气体______g。
(2)计算该鸡蛋壳中碳酸钙的质量_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室保存有一瓶淡黄色固体药品,标签上的药品名称为“过氧化钠(Na2O2)”,但是已经过了保质期。某化学兴趣小组想知道这瓶固体究竟含有哪些物质。他们在老师的指导下进行了实验探究,请你完成兴趣小组的下列实验报告。
(查阅资料)
Ⅰ.过氧化钠是一种淡黄色固体,常用在呼吸面具和潜艇中制造氧气。其原理是:2Na2O2+2CO2═2Na2CO3+O2 2Na2O2+2H2O═4NaOH+O2↑
Ⅱ.常温常压下,O2和CO2的密度分别为1.3g/L、1.8g/L。
(分析猜想)
(1)该小组同学认为,不用做实验,仅由查得的资料和所学知识就可推断该固体一定含有Na2O2.理由是_____。
(2)进一步对固体成分提出以下猜想:
Ⅰ.只有Na2O2;Ⅱ.含有Na2O2和Na2CO3两种物质;
Ⅲ.含有_____两种物质;Ⅳ.含有_____。
(实验操作)
首先按如图连接好装置。用电子秤称取 1.00g 固体样品置于干燥的仪器 X 中,向分液漏斗中加入一定量的蒸馏水。
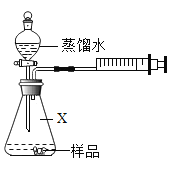
(3)仪器X的名称是_____。打开分液漏斗活塞,将蒸馏水加入仪器X中。反应完全后(无固体剩余),注射器内收集到80.0mL气体,说明样品中含有_____g Na2O2(计算结果保留到小数点后两位)。
(4)更换注射器后,再通过分液漏斗向仪器X 中加入足量稀盐酸,溶液中出现气泡,最终注射器内收集气体的质量为 0.11g。由此可知,样品中含有_____,该物质的质量为_____(计算结果保留到小数点后两位)。
(得出结论)
(5)通过以上实验操作得出结论,猜想_____是正确的(填序号)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】老师给了同学们一包红色粉末,该粉末可能是铜粉和氧化铁(Fe2O3)粉末中的一种或两种。同学们对该粉末进行了定性与定量研究。
(1)定性实验:
实验方案 | 实验现象 | 实验结论 |
取少量红色粉末放入试管 中,滴加足量的稀盐酸振荡 | 红色粉末全部消失,溶液呈棕黄色 | 粉末为Fe2O3 |
_____ | 粉末Cu |
写出“红色粉末全部消失”发生反应的化学方程式_____。
(2)定量实验:
取该粉末4g放入硬质玻璃管中,先通CO,然后再用酒精喷灯加热一段时间,停止加热继续通入CO至装置冷却。实验装置如图:
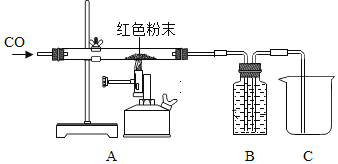
①实验时,先通CO再加热的目的是_____。
②若该粉末全部是氧化铁,在硬质玻璃管中观察到的实验现象是_____。B装置是用于吸收二氧化碳并收集CO,其中盛放的试剂最好是_____。
A NaOH溶液 B 稀盐酸 C 水
如果该实验没有装置B、C,实验造成的危害是_____。
③若该粉末为铜粉和氧化铁的混合物,待装置完全冷却至室温,称量硬质玻璃管内剩余固体的质量为mg。则m的取值范围是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下图回答问题:
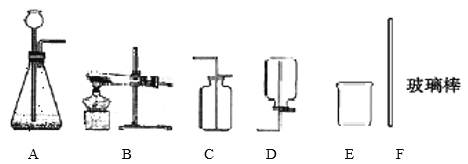
(1)酒精灯加热时,应用温度最高的_____焰。
(2)实验室制取二氧化碳时,选择的发生装置和收集装置依次是______(填字母),该反应的化学方程式是______。
(3)实验室用装置A作为制取氧气的发生装置,反应结束后,若要分离出MnO2,除A~F中相关仪器外,还需补充的一种玻璃仪器是______(写名称)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某实验结束时,同学们将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,如果将废液直接排放就会造成水污染。于是几位同学利用课余处理废液,回收工业重要原料硫酸锌和有关金属。实验过程如下:
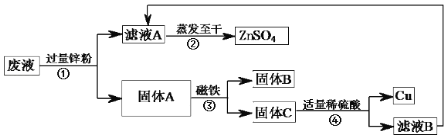
请回答:
(1)步骤①④的操作名称是_____;用到的玻璃仪器除了玻璃棒、烧杯,还有_____;固体A中含_____种物质。
(2)写出步骤①其中一个反应的化学方程式为_____;步骤④发生反应的化学方程式为_____。
(3)检验步骤④中加入的稀硫酸是否足量的方法是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】菱铁矿和赤铁矿一样,也是工业上冶炼铁的一种矿物。某种菱铁矿中铁元素的主要存在形式是碱式碳酸亚铁,为测定碱式碳酸亚铁[xFeCO3yFe(OH)2zH2O]的组成,华雪同在老师的指导下设计了如图实验装置:
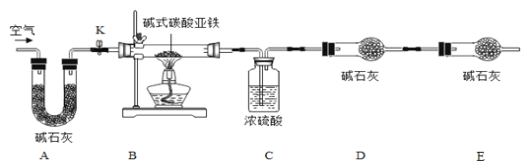
(查阅资料)
a.碱式碳酸亚铁受热会完全分解生成FeO、CO2以H2O。
b.FeO是一种黑色粉末,它不稳定,在空气中加热,可被氧化成四氧化三铁。
c.碱石灰是NaOH及CaO的混合物,可以吸收CO2和H2O
(实验步骤)
(1)检查装置的_____后,准备称取3.40g碱式碳酸亚铁粉末放在装置B中,连接仪器。
(2)_____,鼓入一段时间空气,准确称量装置C、D、E的质量。
(3)关闭弹簧夹K,加热装置B至装置C中导管末端无气泡冒出,再打开弹簧夹K,缓缓通空气一段时间,这样操作的目的是_____。
(4)再次准确称量装置C、D、E的质量,所得数据如下
装置C/g | 装置D/g | 装置E/g | |
加热前 | 200.00 | 180.00 | 180.00 |
加热后 | 200.36 | 180.88 | 180.00 |
(5)分析图、表中数据可知:3.40g碱式碳酸亚铁受热分解过程中生成H2O的质量为_____g,CO2的质量为_____g,装置E的作用是_____。
(实验结论)
在xFeCO3yFe(OH)2zH2O中,氢原子与氧原子的个数之比为_____。
(实验反思)
(1)装置A的作用是_____。
(2)实验结束后,装置B中的残留固体可能全部是FeO.也可能全部是Fe3O4.还可能是_____。
(3)为了得到装置B中残留固体的组成,华雪同学称得装置B中残留固体质量为2.24g后,通过计算可知:残留固体的组成及各成分的质量为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com