
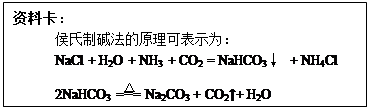
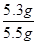 ×100%=96.4%
×100%=96.4%

 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.混合物中CaCO3和KHCO3的质量比一定是1:1 |
| B.混合物充分反应后,所得溶液的质量是(m+n×a%-w)克 |
| C.混合物中CaCO3和KHCO3无论以任何比例混合,消耗稀盐酸的总质量均为n克 |
| D.混合物中CaCO3和KHCO3无论以任何比例混合,生成二氧化碳的总质量均为w克 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题

| A.该食盐中氯元素的质量分数最大 |
| B.每袋食盐中碘元素的质量为10 mg |
| C.每袋食盐中含碘酸钾的质量约为16.9 mg |
| D.若仅靠该盐补充碘,成人每天需摄入该食盐5 g |
查看答案和解析>>
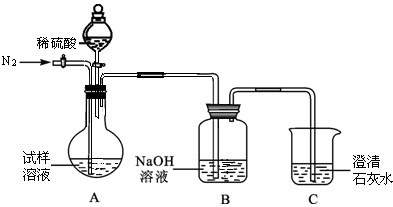
科目:初中化学 来源:不详 题型:计算题
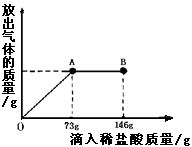
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
| 加入氢氧化钠溶液的总质量/g | 20 | 40 | 60 | 80 | 140 | 160 |
| 生成沉淀的质量/g | 0 | 0 | 1.07 | 2.14 | 5.35 | 5.35 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
 2HCl)
2HCl)查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题

查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com