

| 物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
| 溶解度/g | 36 | 109 | 215 | 9.6 |
| 操作步骤 | 实验现象 | 结论及化学方程式 |
| 取样于试管中, 滴加氢氧化钙溶液 | 猜想②正确 相关的化学方程式 |
| 36g |
| 136g |
| 109g |
| 209g |
| 215g |
| 315g |
| 9.6g |
| 109.6g |
| 106 |
| y |
| 44 |
| 2.2g |
| 5.3g |
| 10% |
| 106 |
| 100 |
| z |
| 5g |
| 5.3g |
| 10% |


科目:初中化学 来源: 题型:
| A、同种溶质的饱和溶液一定比它的不饱和溶液浓 |
| B、析出晶体后溶液溶质质量分数一定变小 |
| C、只要温度不变,其饱和溶液的溶质质量分数一定不变 |
| D、不饱和溶液变为饱和溶液,其溶质的质量分数一定变大 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 有3g混有碳酸钠的氯化钠固体样品,向其中滴加盐酸,加入盐酸的质量与生成二氧化碳气体的质量符合右图所示的质量关系.(不计损耗)
有3g混有碳酸钠的氯化钠固体样品,向其中滴加盐酸,加入盐酸的质量与生成二氧化碳气体的质量符合右图所示的质量关系.(不计损耗)查看答案和解析>>
科目:初中化学 来源: 题型:
 氢化镁(MgH2)常被作为储氢介质,它与几种物质的转化关系如图所示.已知B、E之间发生中和反应,且F是一种盐酸盐.(所有的反应物和生成物均已标出)
氢化镁(MgH2)常被作为储氢介质,它与几种物质的转化关系如图所示.已知B、E之间发生中和反应,且F是一种盐酸盐.(所有的反应物和生成物均已标出)查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验步骤 | 实验现象 | 实验论 |
| Ⅰ.取少量该溶液于试管中,向溶液中滴加过量的 |
有 |
说明原溶液中一定有碳酸钠. |
| Ⅱ.取步骤 I试管中的少量上层清液,滴加酚酞溶液. | 溶液变红色. | 说明原溶液中一定有 |
查看答案和解析>>
科目:初中化学 来源: 题型:
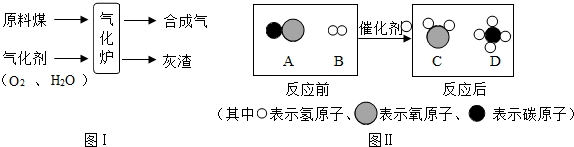
查看答案和解析>>
科目:初中化学 来源: 题型:
 A~K均是初中化学常见的物质.其中A、C都是由两种元素组成的气体,B是赤铁矿的主要成分,H是蓝色沉淀,J是紫红色金属,G是一种化学性质比较活泼的单质,它们的相互转化关系如图所示(反应条件、部分反应物和生成物已略去).请回答下列问题:
A~K均是初中化学常见的物质.其中A、C都是由两种元素组成的气体,B是赤铁矿的主要成分,H是蓝色沉淀,J是紫红色金属,G是一种化学性质比较活泼的单质,它们的相互转化关系如图所示(反应条件、部分反应物和生成物已略去).请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com