
【题目】写出下列反应的化学方程式:
(1)细铁丝在氧气中燃烧: _______
(2)过氧化氢与二氧化锰制取氧气: _______
(3)铁在常温常压与硫酸铜溶液的反应: _______
科目:初中化学 来源: 题型:
【题目】燃烧是人类最早利用的化学反应之一,与人类的生产、生活有密切的联系。
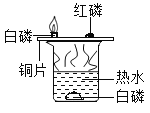
(1)右图是探究燃烧条件的实验,铜片上的白磷燃烧而水中的白磷不燃烧, 说明燃烧需要__________;铜片上的白磷燃烧而红磷不燃烧,说明白磷的着火点比红磷的__________(填“高”或“低”)。
(2)加油站、仓库等地方要张贴“禁止烟火”的标志,是因为这些地方存在着大量的______,当遇火或温度较高时,会发生燃烧甚至爆炸。
(3)实验室用灯帽盖灭酒精灯火焰,其灭火的原理是________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】河南信阳是茶叶之乡,信阳绿茶中的单宁酸具有抑制血压升高、清热解毒、抗癌等功效,其化学式为C76H52O46。下列说法正确的是
A.单宁酸是由三种元素组成的混合物
B.1个单宁酸分子由76个碳原子、52个氢原子和46个氧原子构成
C.单宁酸的相对分子质量为1700g
D.单宁酸中C、H、O元素的质量比为38∶26∶23
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】锰(Mn)是维持人体正常生命活动所必须的微量元素,含锰化合物在生产、生活中也被广泛应用.结合如图中信息,下列叙述正确的是
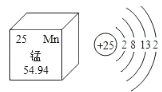
A.锰原子核内有25个质子,一个锰原子的质量是54.94g
B.锰原子核外有4个电子层,其化学性质由最内层电子数决定
C.MnO2属于氧化物,能做所有化学反应的催化剂。
D.锰原子易失去电子
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】元素周期表将已知元素科学有序地排列起来,便于我们研究它们的性质和用途,如图表示元素周期表的一部分,请回答下列问题:
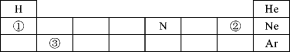
(1)元素在周期表中的分布是有规律的,表中①②③所代表的三种元素中,属于非金属元素的是________ ;(写名称)
(2)表中氮元素的化合价有多种,请写出化合价为+1价的氮的氧化物________(用化学式表示);
(3)随着新元素的不断发现,元素周期表还将逐渐完善,最近,科学家用大量高速钙原子轰击铕原子,形成了117号元素的原子,该元素原子核中一定含有117个________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室开放日,某化学兴趣小组的同学在老师的指导下,设计了如下实验装置进行实验和探究,请回答有关问题。
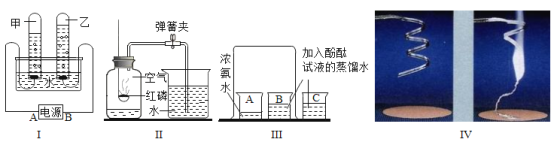
(1)实验I中:甲、乙两试管中产生的气体在相同条件下体积比为__________,其中乙试管中的气体有__________性,因此可用于焊接金属时使用。电解水的化学方程式为____________。
(2)实验Ⅱ中,实验前在集气瓶内加少量水,将集气瓶上方空气分成五等份,并做好记号,红磷熄灭并冷却至室温后,打开弹簧夹,此时可观察到的现象为_____________。如果未等到装置冷却到室温就打开弹簧夹,测得的结果会______(填“偏大”或“偏小”或“无影响”)
(3)实验Ⅲ中观察到的现象是__________,请你用分子的知识解释出现该现象的原因___________;
(4)如图Ⅳ所示,将镁条在空气中点燃。称量燃烧前(镁条)、后(石棉网上灰烬)的质量,发现不相等。
①小明认为镁条燃烧后“石棉网上灰烬的质量”应较反应前“镁条的质量”增加,而小康则认为质量应减少。试陈述两位同学的理由:_________
②若使上述镁条燃烧符合质量守恒定律,应如何改进_________?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】关于分子和原子两种微粒的叙述正确的是
A.物质只能由分子构成B.相同原子可能构成不同的分子
C.分子质量一定大于原子质量D.化学变化中分子数目一定发生变化
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】铁和铁的化合物在工农业生产中有广泛的应用。
(一)铁的应用和防护
A.我国在西汉时期就有“曾青得铁则为铜”之说,用化学方程式表示其原理:_____。
B.铁生锈的主要过程为:
Fe![]() Fe(OH)2
Fe(OH)2![]() Fe(OH)3
Fe(OH)3![]() Fe2O3xH2O
Fe2O3xH2O
(1)写出转化①的化学方程式_____。
(2)转化③生成 Fe2O3xH2O,则 x≤_____(x 为整数)。
C.请提出防止铁生锈的一条措施_____。
(二)铁的化合物应用
黄铁矿(主要成分是FeS2),是一种重要的化工原料,可用来制备硫酸和炼铁(图1)。
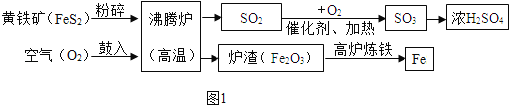
A.工业上将黄铁矿粉碎的目的是_____。
B.生产硫酸后的尾气中含有 SO2,如直接排放可能会造成环境问题是_____。
C.高炉炼铁的化学方程式为_____。
D.150 吨含 FeS280%的黄铁矿理论上最多可制得 98%的浓硫酸_____吨。
(三)铁的冶炼和探究
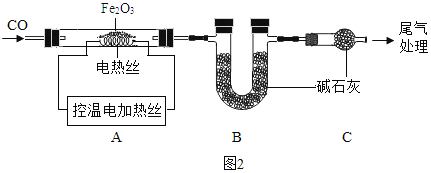
取 24.0g Fe2O3 粉末,小组同学用图2装置模拟炼铁,并测得反应后固体成分。
资料:碱石灰可吸收 H2O 和 CO2。
A.连接装置,先_____,再装入药品。
B.实验时先通入CO,目的是_____。
C.控制A中温度在 700℃至固体全部变黑,继续通CO至冷却。
(1)通过测定装置 B 中固体的质量变化,可准确求得装置 A 中剩余固体质量。装置C的作用是_____。
(2)现直接测得装置 A 中剩余固体质量为19.2g。则装置 B 中固体应增重_____g。
D.经分析A中剩余固体 19.2g 为Fe和 FexOy 的混合物,向其中加入足量的稀 H2SO4充分 反应,得 H20.3g。
(1)固体中 Fe 的质量为_____g。
(2)FexOy 的化学式为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】钙是人体必须的常 量元素,每日必须摄入足够量的钙。目前市场上的补钙药剂很多,如图是某种品牌 的补钙药品的部分说明书。 请回答下列问题:

(1)CaCO3的相对分子质量是___________。
(2)CaCO3中钙元素的质量分数为___________。
(3)若每片钙片的质量为0.5g,则钙片中钙元素的质量分数为___________。
(4)如果每天3次,每次2片,每天摄入钙元素的质量为___________g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com