
在电缆生产过程中会产生一定量的含铜废料.据报道,在通入空气并加热的条件下,铜与稀硫酸反应转化为硫酸铜,该反应的化学方程式为:2Cu+2H2SO4+O2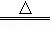 2CuSO4+2H2O.若用一定量溶质的质量分数为9.8%的稀硫酸恰好处理2000g含铜3.2%的废料(假设其他杂质不和硫酸反应且不溶于水),求反应后所得硫酸铜溶液中溶质的质量分数.
2CuSO4+2H2O.若用一定量溶质的质量分数为9.8%的稀硫酸恰好处理2000g含铜3.2%的废料(假设其他杂质不和硫酸反应且不溶于水),求反应后所得硫酸铜溶液中溶质的质量分数.
 科学实验活动册系列答案
科学实验活动册系列答案科目:初中化学 来源: 题型:计算题
将Na2SO4和NaOH的混合物10g投入到200g溶质质量分数为4.9%的H2SO4溶液中恰好完全反应.请计算:
(1)10g混合物中NaOH的质量;
(2)最后所得溶液中溶质的质量.
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
过氧化钠是常用的供氧剂,可将CO2转化为O2,其反应的化学方程式是:2Na2O2+2CO2=2Na2CO3+O2.若有88gCO2参加反应,计算生成O2的质量.
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
某工厂废液中含有氯化钠、氯化铜和氯化亚铁。某课外小组要从废液中回收铜并得到铁红(主要成分Fe2O3),要求全过程不引入其他金属元素。设计实验方案如下图所示。
回答下列问题:
(1)加入过量A溶解后,再进行操作a时玻璃棒的作用是 。
(2)工厂废液中加入过量A反应的化学方程式为 。
(3)固体乙的主要成分是 。
(4)铁红是炼铁的主要原料,用CO和铁红炼铁的化学方程式为 。
(5)某研究性学习小组的同学为了测定某钢铁厂生铁样品中铁的质量分数,在实验室中
称取生铁样品5.8g放入烧杯中,然后再加入足量的稀硫酸,使之充分反应后,共收
集到0.2g氢气(杂质不参加反应)。则该生铁样品中铁的质量分数为 。(列出计算过程,保留一位小数。)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
现有Cu与另一种金属(可能是Mg、Fe、Zn中的一种)形成的粉末。现欲测定其组成,进行如下实验:取该粉末16g放入烧杯,将溶质质量分数为14%的稀硫酸280.0g分4次加入该烧杯中,充分反应后,测得剩余的固体质量数据记录如下:
| 实验次数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸质量/g | 70.0 | 70.0 | 70.0 | 70.0 |
| 剩余固体质量/g | 13.6 | 11.2 | 8.8 | 8.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
化肥的合理使用可以提高农作物的产量,兴化是农业大市,化肥的使用极其普遍。某农业生产公司部分氮肥的销售价格如下:硫酸铵[(NH4)2S04]800元/吨,尿素[CO(NH2)2]2400元/吨。某农民用800元钱去购买氮肥,为了使所购化肥得到的氮最多,你建议他应选购哪种氮肥(请写出计算过程)?
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
某同学为了测定实验室中氯酸钾样品的纯度,取2.5g该样品与0.5g二氧化锰混合.加热该混合物t1时间后(杂质不参加反应),冷却,称量剩余固体质量,重复以上操作,依次称得加热t2、t3、t4时间后剩余固体的质量,记录数据如下表:
| 加热时间 | t1 | t2 | t3 | t4 |
| 剩余固体质量(g) | 2.12 | 2.08 | 2.04 | 2.04 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
用质量分数为5%的稀盐酸和10%的氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图所示:
(1)该实验是将(选填“稀盐酸”或“氢氧化钠溶液”)滴 加到另一种溶液中,该反应的基本类型是 。
(2)当加入溶液的质量a为20 g时,求所得溶液中溶质的质量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com