
| A. | 用铝锅盛放酸性食物 | B. | 菜刀使用后放在潮湿的砧板上 | ||
| C. | 塑料器皿使用时应避免接触火源 | D. | 用水浇灭锅中着火的油 |
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 常见的活泼金属:镁、锌、铜 | |
| B. | 常见的营养素:糖类、蛋白质、无机盐 | |
| C. | 常见的易燃物:汽油、酒精、浓硫酸 | |
| D. | 常见的氧化物:水、氧化铜、熟石灰 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤 | 相关化学反应方程式 |
| 1除去空气中粉尘、二氧化碳、干燥后,再除去氧气. | 除去氧气的化学反应方程式为2Cu+O2$\frac{\underline{\;高温\;}}{\;}$2CuO; |
| 2用上述制得的氮气通入装有碳和三氧化二铝硬质玻璃管中高温制取氮化铝样品(如图1). | 装置中发生化学反应的化学方程式为 N2+3C+Al2O3 $\frac{\underline{\;高温\;}}{\;}$2AlN+3CO. |
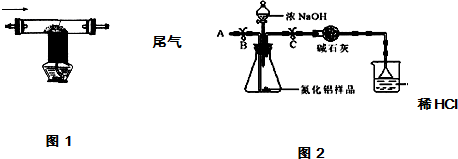
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用熟石灰区分氯化铵和氯化钾 | |
| B. | 用水区分硝酸铵和蔗糖固体 | |
| C. | 用稀硫酸溶液区分黄铜(Cu、Zn)和黄金 | |
| D. | 用硝酸钡区分稀硫酸和硫酸钠溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验编号 | 1 | 2 |
| 反应物 | 6% H2O2 | 6% H2O2 |
| 催化剂 | 1g红砖粉 | 1g MnO2 |
| 时间 | 152s | 35s |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com