
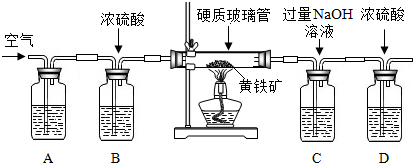
| 实验步骤 | 相关化学反应方程式 |
| 1除去空气中粉尘、二氧化碳、干燥后,再除去氧气. | 除去氧气的化学反应方程式为2Cu+O2$\frac{\underline{\;高温\;}}{\;}$2CuO; |
| 2用上述制得的氮气通入装有碳和三氧化二铝硬质玻璃管中高温制取氮化铝样品(如图1). | 装置中发生化学反应的化学方程式为 N2+3C+Al2O3 $\frac{\underline{\;高温\;}}{\;}$2AlN+3CO. |
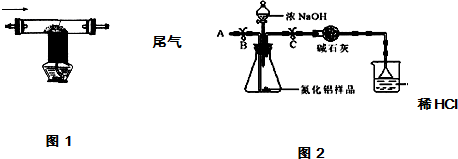
分析 【实验一】
1、根据用灼热的铜网除去空气中的氧气进行解答;
2、根据对反应的说明,在高温下氮气、碳和三氧化二铝反应可以生成氮化铝粉和一氧化碳,写出反应的化学方程式;
【实验二】
【实验讨论】(1)根据对实验操作中需要确保装置气密性的认识,判断实验开始之前应进行的操作;
(2)根据装置中药品或仪器的使用方法,分析实验中所涉及装置的作用,判断所指定装置对实验的影响;
(3)对比稀盐酸、浓盐酸、浓硫酸与稀硫酸在实验中作用的异同来判断;
(4)分析缓缓通入空气的操作对实验中残留气体的影响,推断该操作在实验过程中的目的;
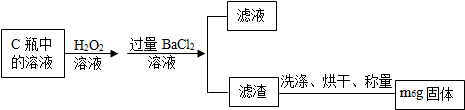
【实验结论】利用所测得氨气的质量,根据反应的化学方程式计算出样品中氮化铝的质量,从而求出样品中氮化铝的质量分数.
事故处理:利用氢氧化钠的性质解答;
拓展探究:(1)剩余的剩余的浓NaOH溶液不能放回原试剂瓶,以免污染药品;
(2)利用AlN+NaOH+H2O=NaAlO2+NH3↑,求出NaOH的质量,进而求出浓氢氧化钠溶液的质量.
解答 解:【实验一】
(1)用灼热的铜网除去空气中的氧气,化学方程式为:2Cu+O2$\frac{\underline{\;高温\;}}{\;}$2CuO;
(2)根据信息:在高温下氮气、碳和三氧化二铝反应可以生成氮化铝粉和一氧化碳,装置D中发生反应化学方程式为:N2+3C+Al2O3 $\frac{\underline{\;高温\;}}{\;}$2AlN+3CO;
【实验二】
【实验讨论】(1)在进行实验前要确保装置气密性良好,因此应先进行气密性的检查;
(2)碱石灰能吸收气体中的水,防止水对测量质量的影响;使用漏斗进行氨气的吸收,可以防止吸收过程中造成溶液的倒吸;
(3)浓盐酸具有挥发性,使测量氨气质量偏小;若使用浓硫酸,浓硫酸吸收空气中的水,使得测量氨气质量偏大,而使结果偏大;可以用稀硫酸代替盐酸;
(4)从导管A处缓缓鼓入一定量的空气,可以使装置内残留的氨气全部被稀硫酸吸收,以保证实验的准确性;
【实验结论】反应生成氨气的质量=203.4g-200g=3.4g,设氮化铝的质量为xg
AlN+NaOH+H2O═NaAlO2+NH3↑
41 17
x 3.4g
$\frac{41}{x}=\frac{17}{3.4g}$
x=8.2g
样品中的氮化铝的质量分数=$\frac{8.2g}{9.1g}$×100%=90%.
事故处理:浓氢氧化钠具有强腐蚀性,不小心将盛有约50mL的浓NaOH溶液打翻在桌面上,立即用稀醋酸中和,然后用水冲洗,再用抹布擦干.
拓展探究:(1)实验后剩余的浓NaOH溶液不能放回原试剂瓶,以免污染药品;NaOH溶液露置在空气中和二氧化碳反应,化学方程式为:2NaOH+CO2═Na2CO3+H2O;
(2)利用AlN+NaOH+H2O=NaAlO2+NH3↑,求出NaOH的质量,进而求出浓氢氧化钠溶液的质量;
设ygNaOH与8.2gAlN完全反应
AlN+NaOH+H2O=NaAlO2+NH3↑
41 40
8.2g y
$\frac{41}{8.2g}=\frac{40}{y}$
y=8g
浓氢氧化钠溶液的质量:8g÷40%=20g.
故答案为:
【实验一】
(1)2Cu+O2$\frac{\underline{\;高温\;}}{\;}$2CuO;(2)N2+3C+Al2O3 $\frac{\underline{\;高温\;}}{\;}$2AlN+3CO;
【实验二】
【实验讨论】(1)装置气密性;
(2)除去气体中的水;防止液体倒吸;
(3)浓盐酸具有挥发性;
(4)使反应产生的氨气充分吸收;
【实验结论】90;
事故处理:立即用稀醋酸中和,然后用水冲洗,再用抹布擦干;
拓展延伸:(1)不能;2NaOH+CO2═Na2CO3+H2O;
(2)20.
点评 通过阅读整个实验过程,理解实验的原理、操作方法及实验目的,为解答此类问题所要着力完成的基础.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:填空题
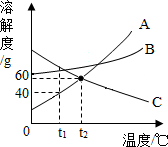 如图A、B、C三种固体物质的溶解度曲线.
如图A、B、C三种固体物质的溶解度曲线.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 物质 性质 | 四氧化三铁 | 氧化亚铁 | 氧化铁 | 铁粉 |
| 颜色 | 黑色 | 黑色 | 红色 | 黑色 |
| 能否被磁铁吸引 | 能 | 不能 | 不能 | 能 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 7.2g | B. | 5.8g | C. | 4.4g | D. | 9.5 g |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com