
分析 二氧化碳的固体干冰,升华时吸收大量的热,可以用于人工降雨和做制冷剂;硝酸钾中的营养元素是钾元素和氮元素,因此是属于复合肥;明矾起净水作用,是常用的净水剂;氮气的化学性质稳定,常用作保护气;氧化钙能和水反应,可做干燥剂;石灰石是常用的建筑材料.
解答 解:(1)二氧化碳的固体干冰,升华时吸收大量的热,可以用于人工降雨和做制冷剂,故答案为:A;
(2)硝酸钾中的营养元素是钾元素和氮元素,因此是属于复合肥,故答案为:B
(3)明矾起净水作用,是常用的净水剂,故答案为:C;
(4)氮气的化学性质稳定,常用作保护气,故答案为:D
(5)氧化钙能和水反应,用于作食品干燥剂,故答案为:E;
(6)石灰石是常用的建筑材料,故答案为:F.
点评 物质的结构决定物质的性质,物质的性质决定物质的用途,要善于根据物质的性质来确定物质的用途.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:选择题
| A. | 它们都显电性 | |
| B. | 它们原子核外电子数目相等 | |
| C. | 它们属于同种元素 | |
| D. | 镁离子是镁原子得到2个电子形成的 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 常见的活泼金属:镁、锌、铜 | |
| B. | 常见的营养素:糖类、蛋白质、无机盐 | |
| C. | 常见的易燃物:汽油、酒精、浓硫酸 | |
| D. | 常见的氧化物:水、氧化铜、熟石灰 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤 | 相关化学反应方程式 |
| 1除去空气中粉尘、二氧化碳、干燥后,再除去氧气. | 除去氧气的化学反应方程式为2Cu+O2$\frac{\underline{\;高温\;}}{\;}$2CuO; |
| 2用上述制得的氮气通入装有碳和三氧化二铝硬质玻璃管中高温制取氮化铝样品(如图1). | 装置中发生化学反应的化学方程式为 N2+3C+Al2O3 $\frac{\underline{\;高温\;}}{\;}$2AlN+3CO. |
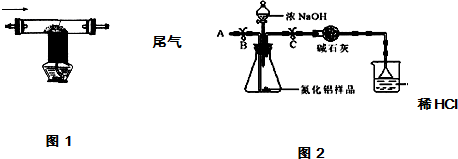
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com