
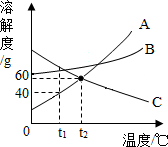
 如图A、B、C三种固体物质的溶解度曲线.
如图A、B、C三种固体物质的溶解度曲线.分析 根据溶解度曲线的意义进行分析解答,在同一温度下,对应的溶解度曲线越高,则溶解度越大;饱和溶液是指在一定温度下在一定量的溶剂里不能再溶解某种溶质的溶液,据此解答.
解答 解:(1)t1℃时,A的溶解度为40g,故A物质的饱和溶液中溶质的质量分数是:$\frac{40g}{100g+40g}×100%$≈28.6%,故填:28.6%;
(2)t2℃时,A和C的溶解度相等,故能配成溶质质量分数相同的A和C的饱和溶液,故填:能;
(3)使t1℃时C物质的不饱和溶液都变成饱和溶液,可以采用升温或减少溶剂或增加溶质的方法,故填:升温;
(4)t2℃时,B物质的溶解度大于C物质的溶解度,故填:大于,
点评 明确溶解度定义及曲线的含义是解答本题关键.


科目:初中化学 来源: 题型:选择题
| 选项 | 实验目的 | 所用试剂或方法 |
| A | 除去氮气中少量氧气 | 通过灼热的氧化铜 |
| B | 除去硝酸钾中的氯化钠 | 加水溶解、蒸发 |
| C | 除去氯化钾溶液中的碳酸钾 | 加入适量的稀硫酸 |
| D | 除去氯化钙溶液中的盐酸 | 加入过量的碳酸钙、过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
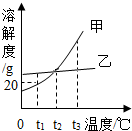 根据如图的溶解度曲线,判断下列说法不正确的是( )
根据如图的溶解度曲线,判断下列说法不正确的是( )| A. | 甲物质的溶解度随温度的升高而增大 | |
| B. | t1℃时,甲的饱和溶液中溶质和溶剂的质量比为1:5 | |
| C. | t2℃时,甲、乙两物质的溶解度相等 | |
| D. | 将t3℃时甲、乙两物质的饱和溶液降温到t1℃,甲析出的晶体多 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 它们都显电性 | |
| B. | 它们原子核外电子数目相等 | |
| C. | 它们属于同种元素 | |
| D. | 镁离子是镁原子得到2个电子形成的 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤 | 相关化学反应方程式 |
| 1除去空气中粉尘、二氧化碳、干燥后,再除去氧气. | 除去氧气的化学反应方程式为2Cu+O2$\frac{\underline{\;高温\;}}{\;}$2CuO; |
| 2用上述制得的氮气通入装有碳和三氧化二铝硬质玻璃管中高温制取氮化铝样品(如图1). | 装置中发生化学反应的化学方程式为 N2+3C+Al2O3 $\frac{\underline{\;高温\;}}{\;}$2AlN+3CO. |
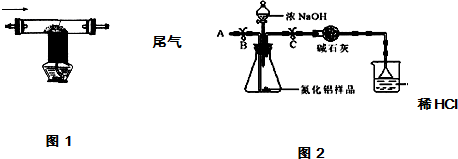
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com