
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 分解反应 | C. | 复分解反应 | D. | 置换反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 在“侯式联合制碱法”的工艺流程中,最后一步是用加热碳酸氢钠的方法来制取纯碱.某纯碱生产厂制得的样品Na2CO3中混有少量NaHCO3.为了测定样品中Na2CO3的质量分数,取100g混合物加热(2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,Na2CO3受热不分解),反应过程中生成二氧化碳气体的质量与反应时间的关系如图所示.
在“侯式联合制碱法”的工艺流程中,最后一步是用加热碳酸氢钠的方法来制取纯碱.某纯碱生产厂制得的样品Na2CO3中混有少量NaHCO3.为了测定样品中Na2CO3的质量分数,取100g混合物加热(2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,Na2CO3受热不分解),反应过程中生成二氧化碳气体的质量与反应时间的关系如图所示.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
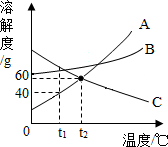 如图A、B、C三种固体物质的溶解度曲线.
如图A、B、C三种固体物质的溶解度曲线.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
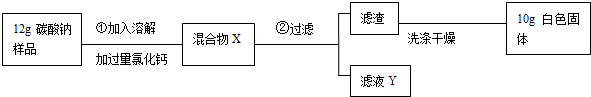
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 具有相同核电荷数(即核内质子数)的一类原子的总称 | |
| B. | 是相对原子质量相同的一类原子的总称 | |
| C. | 是具有相同电子数的一类原子的总称 | |
| D. | 是具有相同中子数的一类原子的总称 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
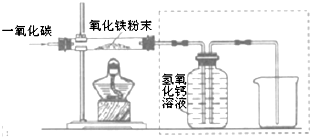
| 物质 性质 | 四氧化三铁 | 氧化亚铁 | 氧化铁 | 铁粉 |
| 颜色 | 黑色 | 黑色 | 红色 | 黑色 |
| 能否被磁铁吸引 | 能 | 不能 | 不能 | 能 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
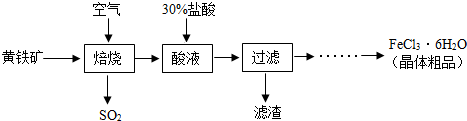
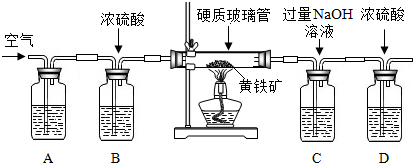
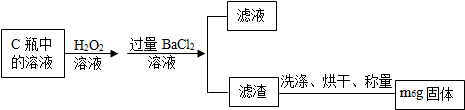
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com