
【题目】铜是一种不活泼的金属,但长期露置在潮湿的空气中会锈蚀生成“铜绿”[化学式:Cu2(OH)2CO3]。某科研小组为探究铜绿生成的条件,并从已部分锈蚀的废铜屑中回收铜(假设不含其它杂质),实验设计如下:
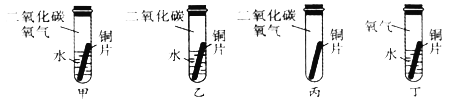
(1)证明生成铜绿的条件除存在O2和H2O外,还必须有CO2。为“证明必须有CO2”需要进行以上实验中的_____(填实验编号)。
(2)利用已部分锈蚀的废钢屑按照以下实验方案回收铜。
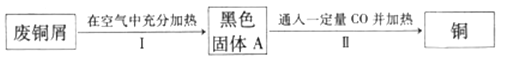
①已知铜绿受热分解为固体A、CO2和H2O,则步骤I中发生的反应类有_____。
②步骤Ⅱ中主要发生的化学反应方程式为_____。
③若步骤Ⅱ所得钢中含有少量Cu2O,你认为可能的原因是_____(写一条即可)。
④若用CO还原16.0gCuO得到Cu和Cu2O混合物的质量为ag,则a的取值范围为_____。
【答案】甲和丁 分解反应、化合反应 CO + CuO![]() Cu + CO2 反应温度不够高 12.8g<a<14.4g
Cu + CO2 反应温度不够高 12.8g<a<14.4g
【解析】
(1)证明生成铜绿的条件除存在O2和H2O外,还必须有CO2。为“证明必须有CO2”需要进行实验甲和丁,即控制变量二氧化碳。
(2)①铜绿受热分解为固体A、CO2和H2O属于分解反应,铜和空气中的氧气加热生成氧化铜是化合反应,则步骤I中发生的反应类型有分解反应、化合反应。
②步骤Ⅱ中主要发生的化学反应方程式为CO + CuO![]() Cu + CO2。
Cu + CO2。
③若步骤Ⅱ所得铜中含有少量Cu2O,可能的原因是反应温度不够高。
④若用CO还原16.0gCuO得到Cu和Cu2O混合物的质量为ag,则a的取值范围为
设得到全部为铜的质量为x

x=12.8g
设得到全部为氧化亚铜的质量为y
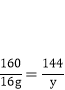
y=14.4g
故12.8g<a<14.4g。


科目:初中化学 来源: 题型:
【题目】氨气在空气中无法燃烧,但在纯氧中可以燃烧,下图是氨气燃烧的实验装置
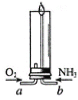
(1)实验开始时,先打开止水夹a通入氧气,再打开止水夹b通入氨气,此时在装置周围都可以闻到氨气特有的刺激性气味,说明_____
(2)在长导管处点燃氨气,氨气在纯氧中安静燃烧。
(3)实验完毕,夹紧止水夹b,火焰即熄灭,利用的灭火原理是_____
(4)已知氨气在氧气中燃烧生成水和一种气体(该气体在空气中体积分数最大),请完成该反应的化学方程式_____
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验课上,同学们利用下列装置进行气体制备的学习,请回答下列问题:
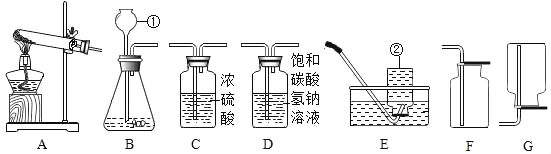
(1)写出编号的仪器名称:①_____,②_____。
(2)写出用A装置制取氧气反应的化学方程式_____,收集装置是_____。
(3)若要制取一瓶纯净、干燥的二氧化碳气体,装置连接的正确顺序是_____→D→C→F,D装置的作用是_____。
(4)现用收集的二氧化碳进行实验,探究CO2与NaOH溶液发生的反应。(提示;Ca(OH)2微溶于水)
①实验一:小雨取一充满CO2的矿泉水瓶,加入一定量的水,立即拧紧瓶盖,振荡,发现瓶子变瘪;小雨另取一相同的充满CO2的矿泉水瓶向其中加入与水等体积的NaOH溶液,立即拧紧瓶盖,振荡,得到溶液X,此时观察到的现象是_____。实验中,小雨采用两只矿泉水瓶做对比实验的目的是_____。
②实验二:为检验CO2与NaOH溶液反应的产物,小亮取实验一所得溶液X少许,向其中滴加BaC12溶液,有白色沉淀产生,该反应的化学方程式:_____,实验中不宜将BaCl2溶液换成CaCl2溶液的原因是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属钛(Ti)抗腐蚀性能好,露置于空气中数年,仍光亮如初。以金红石(主要成分是 TiO2)为原料生产金属钛的步骤主要有:①在高温下,向金红石与焦炭的混合物中通入氯气(Cl2),得到TiCl4和一种可燃性气体;②在稀有气体环境和加热条件下,用Mg和TiCl4反应得到Ti和MgCl2。下列说法不正确的是( )
A. ①中的反应为TiO2+C+2Cl2![]() TiCl4+CO2
TiCl4+CO2
B. ②中的稀有气体的作用是隔绝空气
C. ②中发生的反应为置换反应
D. 金属钛在常温下不与O2反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学利用自制的紫色紫薯汁进行“溶液酸碱性检验”的探究实验,实验现象记录如下。
溶液 | 白醋 | 盐酸 | 蔗糖水 | 肥皂水 | 石灰水 |
加入紫薯汁后溶液的颜色 | 红色 | 红色 | 紫色 | 绿色 | 绿色 |
下列结论或推论错误的是( )
A. 蔗糖水呈中性
B. 溶液的pH:肥皂水![]() 蔗糖水
蔗糖水![]() 白醋
白醋
C. 将等体积的盐酸与石灰水混合,溶液pH一定等于7
D. 将等体积的白醋与盐酸混合,溶液pH一定小于7
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为了研究炼铁原理,某小组用CO与Fe2O3反应进行实验.
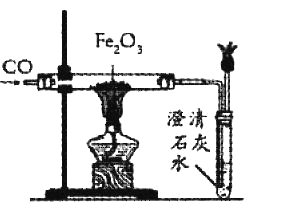
(1)该实验开始时,要先通一会儿一氧化碳再加热,其目的是____________________.
(2)硬质玻璃管内发生反应的化学方程式是____________________.
(3)反应结束时,应先撤酒精灯,继续通CO至玻璃管冷却,目的是______________________.
(4)该装置的不足之处是______________________
(5)反应停止后,同学们对冷却后玻璃管内固体物质的组成成分产生了兴趣,大家纷纷提出自己的猜想.请将你的猜想写出:
猜想一:____________________.
猜想二:____________________.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室里,用如图所示装置还原氧化铁的过程中,可能生成四氧化三铁、氧化亚铁或铁等固体物质。关于该实验,下列说法错误的是( )

A. 实验时,试管中澄清的石灰水变浑浊,证明该反应有二氧化碳生成
B. 实验结束时,玻璃管中红色的氧化铁粉末变成黑色,该产物不一定是铁
C. 反应后,玻璃管中的固体物质的质量比反应前减少了,证明一定有铁生成
D. 为了减少空气污染,应增加尾气处理装置
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】学习结晶时,同学们对硝酸钾的制备产生浓厚兴趣.
(一)通过查阅资料发现硝酸钾在农业市场用途十分广泛,属于复合肥,工业上常采用硝酸钠与氯化钾反应制得硝酸钾和氯化钠(NaNO3+KCl═KNO3+NaCl).利用硝酸钾和氯化钠在不同温度下的溶解度不同可将其分离,具体流程可以表示为:

(1)溶解时需要不断搅拌,其目的是 .
(2)化学实验室蒸发操作所需的玻璃仪器除玻璃棒外还有 .
(3)过滤1操作时要趁热过滤,目的是 .
(4)滤液1一定是 的饱和溶液.
(5)冷却结晶后获得的硝酸钾晶体中还混有少量的NaCl,为获得更纯净的KNO3,还应进行的操作是洗涤、干燥,洗涤最佳的洗涤剂为 .
A.常温下的蒸馏水 B.饱和的NaCl溶液 C.饱和的KNO3溶液
(6)洗涤后的液体应该 .
A.不经处理直接排放到下水道
B.不经处理直接排放到农田
C.倒入原混合溶液中,节约资源并提高产率
(二)为测定洗涤前的粗产品中硝酸钾的质量分数,设计如下实验:取5g粗产品配成50g溶液,然后加入过量的硝酸银溶液(已知NaCl+AgNO3═AgCl↓+NaNO3,硝酸钾和硝酸银不反应),根据沉淀质量先求出NaCl质量,再确定硝酸钾的质量分数.
(7)硝酸银溶液需要过量的原因是 ,证明硝酸银已过量的方法是:静置后,在上层清液中加入硝酸银溶液,如果观察到 (填有或无)沉淀生成,则已过量.
(8)在其他操作均正确的情况下,若在配制溶液过程中,仰视刻度量取蒸馏水,则所配制溶液中的硝酸钾的质量分数 (填偏大、偏小或无影响),对所测定的粗产品中硝酸钾的质量分数 .(填偏大、偏小或无影响)
(9)经精确测定AgCl沉淀的质量为1.435g,计算该粗产品中硝酸钾的质量分数 .(请写出计算过程,相关物质的相对分子质量:NaCl 58.5,AgCl 143.5).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】ZnSO4 饱和溶液的溶质质量分数随温度变化的曲线如图所示。说法正确的是
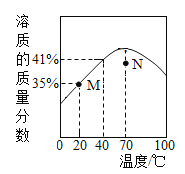
A. M 点对应的 ZnSO4 溶液是不饱和溶液
B. N 点对应的 ZnSO4 溶液升温或降温均都可能析出晶体
C. ZnSO4 饱和溶液的溶质质量分数随温度升高而增大
D. 40℃时,ZnSO4 的溶解度为 41g/100g 水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com