
【题目】硬水中含有一定量的Ca(HCO3)2和Mg(HCO3)2,某兴趣小组的同学将一定量的硬水煮沸后出现白色固体,该小组的同学探究其成分。
查阅资料:已知可溶性的Ca(HCO3)2加热会分解,出现白色沉淀和能使澄清石灰水变浑浊的气体,分解的化学方程式为_________
【提出问题】硬水煮沸后的白色固体中还含有什么物质?
【猜想】 甲:MgCO3; 乙:Mg(OH)2; 丙:MgO
【实验】
(1)甲同学取白色固体,加入适量的稀盐酸,观察到有气泡产生,认为自己的猜想正确,其他同学否定了他的结论,理由是_______
(2)乙同学称取10.8g白色固体,设计如下实验确定固体组成:

①反应前,先通一段时间的空气,目的是_____________。
②加热一段时间后,装置C中可观察到_______(填实验现象),证明乙同学的猜想成立。
③实验中E装置的作用是___________________。
④充分反应后,测得C增重1.8g,D中增重4.4g。
【结论】(1)白色固体中各成分的质量比为______。
(2)写出Mg(HCO3)2受热分解的化学方程式_____________。
【答案】 Ca(HCO3)2=== CaCO3↓+CO2 ↑+H2O CaCO3与稀盐酸反应也会产生气泡 排尽装置内空气中的水和二氧化碳 白色固体变蓝 防止空气中的二氧化碳和水进入D装置 58:50 Mg(HCO3)2===Mg(OH)2↓+2CO2 ↑
【解析】根据题给信息,反应的化学方程式为 Ca(HCO3)2△CaCO3↓+CO2 ↑+H2O 【实验】(1) CaCO3与稀盐酸反应也会产生气泡。 (2)①排尽装置内空气中的水和二氧化碳,防止对实验的干扰。②难溶性的碱在加热时发生分解反应有水生成,无水硫酸铜遇水变蓝。③防止空气中的二氧化碳和水进入D装置。 ④C增重1.8g,是生成了1.8g的水,设固体中Mg(OH)2的质量为x,Mg(OH)2 △ MgO+ H2O
58 18
x 1.8g
![]() =
=![]() 解得x=5.8g
解得x=5.8g
固体中碳酸钙的质量为:10.8g-5.8g =5g,白色固体中各成分的质量比为:5.8g :5g=58:50(2)Mg(HCO3)2受热分解的化学方程式是Mg(HCO3)2===Mg(OH)2↓+2CO2 ↑


科目:初中化学 来源: 题型:
【题目】过氧化钠(Na2O2)是一种供氧剂,与水反应的化学方程式为2Na2O2+2H2O═4NaOH+O2↑。将10g含过氧化钠78%的过氧化钠样品(只含有NaOH杂质)加入到85.2g质量分数为10%的氢氧化钠溶液中充分反应(水的挥发忽略不计)。请计算:
(1)生成氧气的质量。
(2)反应后所得溶液中溶质的质量分数。
(3)若将反应后的溶液的溶质质量分数恢复到10%,需加入水的质量。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】将16.8gNaHCO3固体加热一段时间后剩余固体13.7g,下列说法错误的是( )
A. 剩余固体为混合物
B. 剩余固体中钠元素的为4.6g
C. 反应生成CO2的质量为3.1g
D. 加热前后的固体分别与相同浓度稀盐酸恰好完全反应所消耗盐酸质量相等
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组对某铜锌合金样品进行探究实验。称取样品10.0克,再用100.0克稀硫酸溶液逐滴滴入,实验情况如图所示。求:
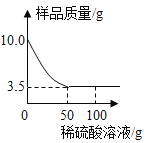
(1)铜锌合金汇中,Zn的质量分数是 。
(2)所用稀硫酸溶液中溶质的质量分数是多少?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】饮用水的pH在6.5~8.0之间,才符合健康标准.若要使pH低于6.5的天然水达到饮用水的酸碱度范围,下列处理方法最可行的是
A. 加入适量纯碱 B. 加热
C. 加入适量食醋 D. 加入适量明矾
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】石灰石在生产生活中有广泛的用途。
(1)煅烧石灰石可制得活性CaO,反应的化学方程式为___________________。
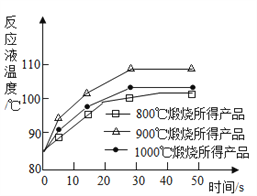
(2)为测定不同煅烧温度对CaO活性的影响,取石灰石样品分为三等分,在同一设备中分别于800℃、900℃和1000℃条件下煅烧,所得固体分别与等质量的水完全反应,测得反应液温度随时间的变化如下图所示。可知:CaO与水反应会_________热量(填“放出”或“吸收”);上述温度中,______℃煅烧所得CaO活性最高。要得出正确结论,煅烧时还需控制的条件是________ 。
(3)以电石渣(主要成分为Ca(OH)2,还含有少量MgO等杂质)为原料制备高纯CaCO3的流程如下:
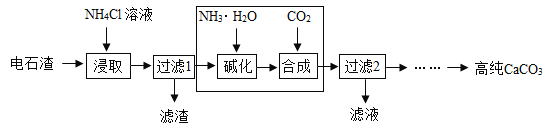
①如图为NH4Cl浓度对钙、镁浸出率的影响:
(浸出率=![]() ×100%)
×100%)
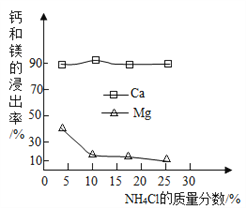
可知:较适宜的NH4Cl溶液的质量分数为________;浸取时主要反应的化学方程式为________________
②流程中方框内部分若改用_______________溶液(填化学式),可一步得到与原流程完全相同的生成物。
③流程中方框内部分若改用Na2CO3溶液,也能得到高纯CaCO3,试从生成物的角度分析原流程的优点:
a.NH3可循环利用;研究 b.________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】物质世界每时每刻都在发生着变化,下列变化属于化学变化的是( )
①电灯通电发光②煤制成焦炭③塑料老化④干冰升华⑤石油分馏
⑥海水制镁⑦石块粉碎成石子⑨粮食酿酒
A. ①③④⑧ B. ②⑤⑥⑧ C. ②⑨⑥⑨ D. ①④⑥⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com