
【题目】根据KNO3和NaCl的溶解度曲线,回答下列问题:
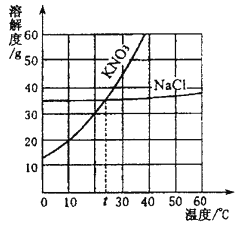
(1)10℃时 KNO3的溶解度_____________(填“>”、“<”或“=”)NaCl的溶解度。
(2)t℃时,将mg KNO3、ngNaCl分别溶解在20mL水中恰好饱和,则m___n(填 “>”、“<”或“=”)。
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】锂矿是重要的国家战略资源,有着21世纪改变世界格局的“白色石油”和“绿色能源金属”之称。2019年诺贝尔化学奖颁给了研究锂离子电池的科学家。如图是锂原子结构示意图和在元素周期表中的相关信息,据此回答下列问题。
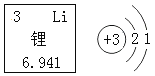
(1)锂元素属于_________(填“金属”或“非金属”)元素。
(2)10—18号元素中________(填元素符号)的化学性质与锂元素相似。
(3)标出氧化锂中锂元素的化合价________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2020年3月22-28日是“中国水周”,其主题为“坚持节水优先,建设幸福河湖”。爱护水资源人人有责,我们应该了解一些有关水的知识。请回答:
(1)下列“水”属于纯净物的是___________(填序号)。
a.蒸馏水
b.河水
c.自来水
d.矿泉水
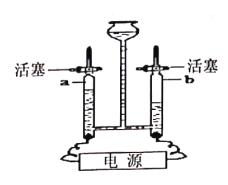
(2)用如图甲装置进行电解水的实验,a中收集到的气体是________(填名称), 该实验说明水是由_________组成的。
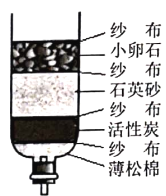
(3)云南水资源丰富,但分布不均,有些村民用地下水作为生活用水,人们常用_____________检验地下水是硬水还是软水;生活中可用_________的方法降低水的硬度;某同学自制如图乙所示简易净水器,图中活性炭的主要作用是________________。纱布、小卵石、石英沙的作用是_______________。
(4)请举一例节约用水的具体措施:________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碳酸氢铵是一种常用的化肥,小组同学对碳酸氢铵进行相关的探究:
[查阅资料] (1)碳酸氢铵是一种白色粒状晶体,有氨味,易溶于水。
(2)氨气具有刺激性气味,极易溶于水,能使湿润的红色石蕊试纸变蓝。
[提出问题]碳酸氢铵有哪些化学性质?
[作出猜想]猜想一:碳酸氢铵能与酸反应;
猜想二:碳酸氢铵能与碱反应;
猜想三:碳酸氢铵易分解。
[设计与实验]
实验操作 | 实验现象 | 实验结论 | |
1 | ______ | 有气泡产生 | 猜想一正确 |
2 | 取少量碳酸氢铵样 品与熟石灰混合研磨 | ____ | 猜想二正确 |
3 |
| 红色石蕊试纸变蓝,澄清石灰水变浑浊 | 猜想三正确,B中发生反应的化学方程式 为____ |
[反思] (1)实验3中向水中加入氧化钙的目的是_______。
(2)有同学对实验2的结论提出质疑:碳酸氢铵易分解产生有刺激性气味的气体,研磨会使温度升高,能加快碳酸氢铵分解,所以实验2的结论不严谨。
[补充探究]有同学为了进一步验证猜想二,进行如下实验:
实验操作 | 实验现象 |
①将碳酸氢铵溶液加入到氢氧化钙溶液中 | 有白色沉淀生成,但没有气体逸出 |
②将碳酸氢铵溶液加入到氢氧化钠溶液中 | 有刺激性气味的气体生成 |
[分析]根据常见酸、碱、盐的溶解性分析,①实验中生成的白色沉淀是____,实验中没有气体逸出可能的原因是_______。
[实验结论]三个猜想均正确。
[拓展应用]保存或使用碳酸氢铵时,需注意_______(写出一点)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】过氧化钙( CaO2)是用途广泛的优良供氧剂。以电石渣[主要成分为Ca(OH)2,含少量CaCO3]为原料制备CaO2的一种工艺流程如下:
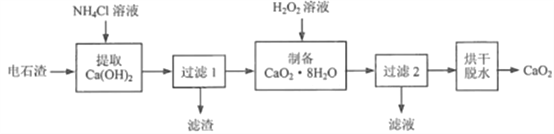
(查阅资料)I. Ca(OH)2+2NH4Cl=CaCl2+2NH3·H2O
Ⅱ.CaCl2+2NH3·H2O+H2O2 +6H2O= CaO2·8H2O↓+ 2NH4Cl
Ⅲ. CaO2·8H2O在水中不太稳定,会缓慢分解。
(1)“提取Ca(OH)2”时反应的基本类型是_______;Ca(OH)2的俗名为_______;“过滤1”所得滤渣的主要成分是_______。
(2)在实验室进行过滤操作时,要遵循“一贴、二低、三靠”原则。其中“二低”指的是:滤纸边缘略低于漏斗口、_______。生产过程中为了精确测定溶液的pH,常使用_______ (填仪器名称)。
(3)在其他条件不变的情况下,制备CaO2·8H2O的反应时间(t)对其产率(w)的影响如图所示。
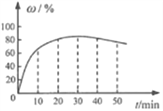
①平均反应速率最快的时间段为:_______ (填字母)。
a. 0~10min b. 10~20min c. 20~30min d.30~40min
②30min后,w开始下降的主要原因是_______。
(4)为了测定加入的NH4Cl溶液中溶质的质量分数,取30.00g NH4Cl溶液于烧杯中,加入稍过量的AgNO3溶液,完全反应后过滤、洗涤、干燥、称量,得到14.35g 白色固体。通过计算确定该溶液中NH4Cl的质量分数(精确到0.1%)____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】四种物质在一定的条件下充分混合反应,测得反应前后各物质的质量分数如图所示。则有关说法中错误的是( )
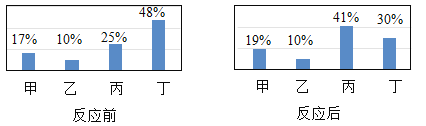
A.丁是化合物
B.乙可能是这个反应的催化剂
C.参加反应的丁的质量一定等于生成甲和丙的质量之和
D.反应过程中丁、丙两物质的质量比为5:8
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A﹣K为中学常见的物质,其中A为黑色粉末,H是一种建筑材料的主要成分,它们之间的转换关系如图所示:
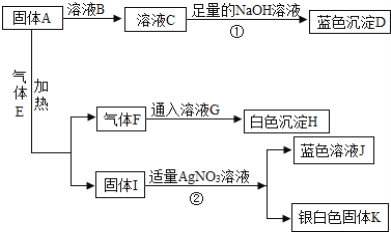
(1)D,F的化学式:D___,F____。
(2)蓝色溶液中的蓝色是因为含____离子(填写化学式)。
(3)反应②的化学方程式是_____。
(4)气体E的用途是______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水和溶液在生产、生活中起着十分重要的作用,请回答下列问题。
(1)①自然界中的水都不是纯水,通过过滤可除去水中的_________ (填“不溶性”或“可溶性”)杂质。
② 热水瓶用久后,瓶胆内壁常附着一层水垢(主要成分是CaCO3和Mg(OH)2),可用稀盐酸来洗涤。写出盐酸与Mg(OH)2反应的化学方程式_____________________。
③ 某熟石灰久置于空气中,部分变质生成了碳酸钙,取l0g该熟石灰样品与足量的稀盐酸 充分反应后,生成l.lg二氧化碳,则l0g该样品中氢氧化钙的质量分数为多少?(请写出计算过程)_____
(2)如图是硝酸钾和氯化钠的溶解度曲线,回答下列问题。
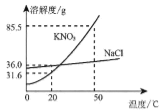
① 在50℃时,硝酸钾的溶解度是85.5g。这句话的含义是_______________。
② 20℃时,若从氯化钠和硝酸钾两种物质的饱和溶液中析出等质量的固体,须恒温蒸发掉较多水的是_________ (填“氯化钠”或“硝酸钾”)的饱和溶液。
③ 20℃时,在进行“粗盐中难溶性杂质的去除”实验过程中,如要溶解8g粗盐(粗盐中氯化钠含量约为80%)应选择_________ (填“l0mL”、“20mL”或“50mL”)规格的量筒,量取所需要的水最为合适。
④ 实验室用氯化钠固体配制50gl5%的氯化钠溶液,在溶解过程中,玻璃棒的作用是______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示为a、b、c三各固体物质的溶解度曲线。请回答下列问题:
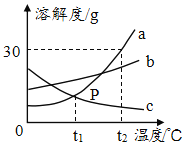
(1)P点是a、c两条曲线的交点,其含义是_____。
(2)t2℃时,将a物质20g加入到50g水中,充分搅拌后所得溶液的质量是_____g。
(3)t2℃时,将a、b、c的饱和溶液各100g,分别降温至t1℃,所得溶液中溶质的质量分数由大到小的顺序是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com